pH y cambio de color
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
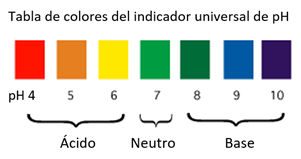
- Saber si una solución es ácida o básica puede medirse en la escala de pH.
- Cuando se añade un indicador universal a una solución, el cambio de color puede indicar el pH aproximado de la solución.
- Los ácidos hacen que la solución indicadora universal cambie de verde a rojo.
- Las bases hacen que el indicador universal cambie de verde a violeta.
- Las moléculas de agua (H2O) pueden interactuar entre sí para formar iones H3O+ y iones OH−.
- A un pH de 7, hay cantidades iguales de iones H3O+ y de iones OH− en agua, lo que se denomina solución neutra.
- Las soluciones ácidas tienen un pH por debajo de 7 en la escala de pH.
- Las soluciones básicas tienen un pH superior a 7 en la escala de pH.
Resumen
Los alumnos verán una demostración de un cambio de color utilizando un indicador universal de pH. Los alumnos cambiarán las concentraciones de un ácido y una base, y utilizarán un indicador universal para probar el pH de las soluciones resultantes. Los alumnos verán una animación que muestra que las moléculas de agua interactúan y se separan en el ion H3O+ y el ion OH-. Los alumnos verán que el pH de una solución está relacionado con la concentración de estos iones en agua.
Objetivo
Los alumnos podrán explicar, a nivel molecular, que el pH es una medida de la concentración de los iones H3O+ en agua y que añadir un ácido o una base al agua afecta la concentración de estos iones.

Seguridad
Asegúrate de que tú y tus alumnos lleven gafas de seguridad apropiadas durante la actividad y de que se laven las manos después de ella. El carbonato de sodio puede irritar la piel. El ácido cítrico es un irritante ocular. El indicador universal es a base de alcohol e inflamable. Lee y sigue todas las advertencias de seguridad de la etiqueta. Al final de la lección, pide a los alumnos que viertan sus soluciones usadas en un contenedor de residuos. Desecha estos residuos por el desagüe o de acuerdo con la normativa local. Los restos de polvo de ácido cítrico y de carbonato de sodio se pueden desechar en el cesto de basura de la clase.
Materiales para la demostración
- 3 vasos de plástico transparente
- Ácido cítrico
- Carbonato de sodio
- Solución indicadora universal
- Agua
Materiales para cada grupo
- 3 vasos de plástico transparente
- Cinta de enmascarar y bolígrafo o marcador permanente
- Solución indicadora universal
- Tabla de color de pH
- Agua
- Ácido cítrico
- Carbonato de sodio
- Cilindro graduado
- Al menos 12 palillos de dientes planos
- 2 platinas de 6 pocillos o 1 platina de 12 pocillos
- 3 goteros
Acerca de los materiales
Para esta lección, cada grupo necesitará una tabla universal de color indicador del pH. Imprime suficientes páginas de estas tablas en una impresora a color para que cada grupo pueda tener su propia tabla.
- Tabla de colores del indicador universal de pH PDF
Cada grupo también necesitará solución indicadora universal, ácido cítrico (anhidro) y carbonato de sodio (anhidro; para uso en laboratorio). Cada grupo necesitará dos platinas de 6 pocillos o una platina de 12 pocillos.
Acerca de esta lección
Debido a sus propiedades químicas, las reacciones que afectan a los ácidos y las bases son diferentes de las reacciones químicas que los alumnos han visto hasta ahora en el Capítulo 6. En las lecciones anteriores, siempre eran los electrones los que se compartían o transferían cuando los átomos interactuaban. En las siguientes tres lecciones sobre ácidos y bases, las cosas son un poco diferentes. Con los ácidos y las bases, un protón de un átomo de hidrógeno es el que se transfiere de una sustancia a otra.
El aspecto principal de los ácidos y las bases que los alumnos explorarán en las tres lecciones siguientes trata sobre la influencia que ejercen los ácidos y las bases sobre el agua. Las reacciones de los ácidos y las bases con agua se miden utilizando la escala de pH. Comprender el pH a nivel molecular permitirá a los alumnos valorar más algunos de los problemas ambientales que implican los ácidos y las bases. El significado del pH y la forma en que se ve afectado por los ácidos y bases puede ser un poco complicado, pero mediante animaciones, dibujos y algunas simplificaciones, los alumnos deben poder comprender las ideas principales.
Descarga todos los recursos de la Lección 6.8
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 6.8 - pH y cambio de color."
Instrucciones
1 Involúcrate
Paso 1
Añade solución indicadora universal a un ácido y una base ocultos en vasos “vacíos” para demostrar cómo un ácido y una base pueden cambiar el color de un indicador de pH.
Materiales para la demostración
- 3 vasos de plástico transparente
- Ácido cítrico
- Carbonato de sodio
- Solución indicadora universal
- Agua
Nota: Es probable que el agua corriente de tu zona sea apropiada para la demostración y las actividades de esta lección. Si la solución indicadora que generas no es verde, significa que el agua es ácida o básica. Si esto sucede, utiliza agua destilada, que se vende en supermercados y farmacias.
Preparación del maestro
Hacer una solución indicadora para los grupos de alumnos
- Prepara una solución indicadora universal diluida para esta demostración y para cada grupo de alumnos combinando 250 ml de agua con 10 ml de solución indicadora universal.
- Vierte unos 25 ml de esta solución indicadora universal diluida en un vaso limpio para cada grupo de alumnos.
Nota: En la actividad, los alumnos llenarán 12 pocillos con solución indicadora universal. Verifica que 25 ml de solución sean suficientes. Necesitarás unos 50 ml de solución indicadora para la demostración. Si 250 ml de solución no son suficientes, prepara más utilizando las mismas proporciones.

Preparación para la demostración
- Vierte unos 50 ml de solución indicadora en un vaso de plástico transparente para usarla en la demostración.
- Con dos vasos de plástico transparentes vacíos, añade aproximadamente 1⁄8 de cucharadita de ácido cítrico a un vaso y 1⁄8 de cucharadita de carbonato de sodio a la otra. No les digas a los alumnos que has añadido algo a los vasos.

Procedimiento
- Vierte aproximadamente ⅓ de la solución indicadora en el vaso de ácido cítrico y ⅓ en el vaso de carbonato de sodio. Deja ⅓ en el vaso indicadora.
Resultados esperados
El ácido cítrico cambia el indicador de verde a rojizo. El carbonato de sodio cambia el indicador de verde a violeta.
Cuéntales a los alumnos que has colocado algo en los vasos de antemano.
Pregunta a los alumnos:
- ¿Creen que se trataba de una reacción química? ¿Por qué sí o por qué no?
Un cambio de color es a menudo una pista de que se ha producido una reacción química. Por lo tanto, el cambio de color en cada vaso es probablemente el resultado de una reacción química. (Este punto se explica en el Capítulo 6, Lección 6). - ¿Dirías que las sustancias que estaban en los vasos antes de añadir el líquido eran las mismas o eran diferentes? ¿Por qué?
El líquido de cada vaso cambió a un color diferente durante la reacción. Debido a que las sustancias reaccionan químicamente de manera característica y a que las sustancias reaccionan de manera diferente, las sustancias en cada vaso deben ser diferentes.
Diles a los alumnos que la solución verde se creó añadiendo una sustancia llamada indicador universal al agua. Explica que has colocado una pequeña cantidad de una sustancia, un ácido y una base en cada vaso. No les digas a los alumnos en qué vaso está el ácido o la base.
Diles a los alumnos que, cuando volcaste la solución del indicador universal a los vasos, el ácido y la base reaccionaron con el indicador y cambiaron de color. Normalmente, cuando se mezclan dos sustancias y se produce un cambio de color, esto es una pista de que se ha producido una reacción química. La causa de este cambio de color se comentará más adelante en esta lección, cuando los alumnos realicen su propia actividad.
Diles a los alumnos que utilizarán una solución ácida, una base y una solución indicadora universal para aprender cómo los ácidos y las bases afectan al agua. También aprenderán a medir el efecto con colores y números en la escala de pH.
Paso 2
Pide a los alumnos que comparen el color de las soluciones fabricadas en la demostración con los colores de la tabla universal indicadora de pH.
Distribuye una tabla universal de pH indicador a cada grupo. Pueden encontrar las tablas justo antes de las hojas de actividades de los alumnos. Explica que la tabla muestra el rango de cambios de color para el indicador universal cuando se añaden soluciones ácidas o básicas al indicador.
Señala que cada color tiene un número asociado y que los alumnos aprenderán más sobre estos números más adelante en la lección. A medida que la solución se vuelve más ácida, el color cambia de verde a rojo. A medida que la solución se vuelve más básica, el color cambia de verde a violeta.
Levanta los vasos de la demostración y formula las siguientes preguntas:
- ¿Qué les dice el color del líquido de cada vaso sobre la sustancia que ya estaba en el vaso cuando se añadió el indicador?
El vaso que se volvió rojizo al principio contenía un ácido, y el vaso que se volvió violeta inicialmente contenía una base. - ¿Qué les dice el color verde del indicador sobre el agua en ese vaso? ¿Es ácida, básica o ninguno de los dos?
El indicador verde que queda en el vaso no es ácido ni básico, por lo que debe ser neutro.
Paso 3
Presenta el ácido y la base usados en la demostración y analiza cómo puede cambiar el color del indicador universal con otros ácidos y bases comunes.
Explica que antes de la clase, colocaste una pequeña cantidad de ácido cítrico en el vaso que se volvió rojo y una pequeña cantidad de carbonato de sodio en el vaso que se volvió violeta. El ácido cítrico es un ácido y el carbonato de sodio es una base.
Ácidos y la solución indicadora universal
Explica que el ácido cítrico está presente en frutas cítricas como los limones, las limas y las naranjas.
Pregunta a los alumnos:
- ¿Cuáles son otros ejemplos frecuentes de ácidos?
Los alumnos podrían decir que el vinagre es un ácido. Podrías señalar que también hay ácidos más fuertes, como el ácido sulfúrico utilizado en las baterías de los coches. - ¿Qué colores esperarían ver si colocaran alguna de estas sustancias en el indicador universal?
El color puede cambiar a amarillo, naranja o rojo para estos ácidos.
Bases y la solución indicadora universal
Explica que el carbonato de sodio es uno de los productos químicos que se utilizan habitualmente en los detergentes para lavavajillas.
Pregunta a los alumnos:
- ¿Cuáles son otros ejemplos comunes de bases?
Es posible que los alumnos no conozcan ningún ejemplo de base, pero puedes decirles que los jabones, el amoníaco y otros limpiadores suelen ser bases. - ¿Qué colores esperarían ver si colocaran alguna de estas sustancias en el indicador universal?
El color puede cambiar a verde oscuro, azul y violeta para cualquiera de estas bases. (Para el indicador universal, los cambios en el color de las bases no son tan diferentes como los de los ácidos).
Diles a los alumnos que a continuación explorarán los cambios de color del indicador universal con pequeñas cantidades de ácido cítrico y de carbonato de sodio.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 6.8 Hoja de actividades PDF | DOCX | Google Doc
- Lección 6.8 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
Descarga la hoja de actividades del alumno y reparte una por alumno cuando se especifique en la actividad. La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Para encontrar las respuestas a la hoja de actividades, ve al área de descargas de la versión en línea de esta lección.
3 Explora
Paso 4
Pide a los alumnos que preparen las soluciones para la actividad.
Explica a los alumnos que primero crearán sus soluciones para la actividad. Revisa cada paso con ellos o haz que sigan el procedimiento descrito en su hoja de actividades.
Preparación del maestro
Los alumnos necesitarán pequeñas cantidades de carbonato de sodio y de ácido cítrico para la actividad.
- Etiqueta dos vasos de plástico pequeños con los nombres “ácido cítrico” y “carbonato de sodio” para cada grupo.
- Coloca aproximadamente 1⁄4 de cucharadita de ácido cítrico y de carbonato de sodio en los recipientes etiquetados.
- Distribuye los vasos con solución indicadora universal a cada grupo de alumnos.
Materiales para cada grupo
- 2 vasos de plástico transparente
- 3 goteros
- Cinta de enmascarar y bolígrafo o marcador permanente
- Indicador universal en un vaso
- Agua
- Cilindro graduado
- Carbonato de sodio
- Ácido cítrico
- 2 palillos de dientes planos

Etiqueta tu equipo
- Utiliza cinta adhesiva y un bolígrafo para etiquetar un vaso con el nombre solución de ácido cítrico y otro vaso con el nombre solución de carbonato de sodio.
- Utiliza un pequeño trozo de cinta de enmascarar y un bolígrafo para rotular uno de los goteros con el nombre solución de ácido cítrico y el otro con el nombre solución de carbonato de sodio.

- Usa el cilindro graduado para añadir 5 ml de agua al vaso con la etiqueta de ácido cítrico.
- Usa un palillo de dientes plano para recoger tanto ácido cítrico como puedas en el extremo del palillo de dientes, como se muestra.
- Añade este ácido cítrico al agua del vaso con ácido cítrico. Agita suavemente hasta que el ácido cítrico se disuelva.
- Utiliza el cilindro graduado para añadir 5 ml de agua al vaso etiquetado “carbonato de sodio”.
- Utiliza un palillo plano para recoger tanto carbonato
- de sodio como puedas en el extremo del palillo.
- Añade este carbonato de sodio al agua del vaso de carbonato de sodio. Agita suavemente hasta que el carbonato de sodio se disuelva.
Paso 5
Explica lo que harán los alumnos en la siguiente actividad y discute el propósito de tener un control.
Explica a los alumnos que, en esta actividad, llenarán los pocillos de cada platina con solución indicadora universal. A continuación, en la primera platina, analizarán cómo afectan las diferentes concentraciones de ácido cítrico al color de la solución indicadora universal. En la otra platina, analizarán cómo afectan las diferentes concentraciones de carbonato de sodio al color de la solución indicadora universal.
Diles a los alumnos que no añadirán nada en cada platina a la solución indicadora en el primer pocillo. Esto se debe a que el primer pocillo servirá como control.
Pregunta a los alumnos:
- ¿Por qué es importante tener un control?
El control no se toca y no cambia para que los cambios de color en los otros pocillos se puedan comparar con el color original del control.
Paso 6
Pide a los alumnos que analicen el aumento de las concentraciones de la solución de ácido cítrico.
Pregunta para investigar
¿Cómo afecta la concentración de ácido cítrico al color de la solución indicadora universal?
Materiales para cada grupo
- Solución indicadora universal
- Tabla de color de pH
- Solución de ácido cítrico
- Al menos 6 palillos de dientes
- Platina
- 2 goteros
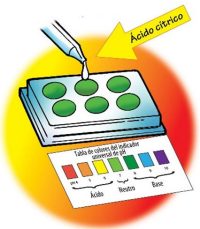
Procedimiento
Analizar la solución de ácido cítrico
- Usa uno de los goteros para llenar casi por completo 6 pocillos pequeños en la primera platina con la solución indicadora universal. Coloca la tabla de colores del indicador universal de pH delante de la platina.
- Usa el gotero para añadir 1 gota de solución de ácido cítrico al segundo pocillo. Mezcla suavemente el líquido con un palillo de dientes limpio.
- Compara el color del líquido con el control y con la tabla de colores del indicador universal de pH. Registra el color del indicador, la cantidad de palillos de dientes con ácido cítrico y el número de pH en la tabla para el pocillo 2.
Resultados esperados
El color del indicador debe volverse verde amarillento o amarillo. Si no hay un cambio de color evidente después de añadir una cucharadita pequeña de ácido cítrico con el palillo de dientes, pide a los alumnos que añadan un poco más de ácido cítrico a la solución. Diles que se aseguren de recoger tanto ácido cítrico como puedan en el extremo del palillo de dientes.
Registrar observaciones
Ayuda a los alumnos a completar la tabla en su hoja de actividades. Los alumnos pueden decir que el color de la solución en el pocillo 2 es amarillo o verde amarillento. A continuación, pide a los alumnos que asignen un número para el pH. Diles a los alumnos que si el color del pocillo parece estar entre dos colores de la tabla, deben asignar un valor de pH entre los dos.
Diles a los alumnos que en la siguiente parte de la actividad añadirán un poco más de ácido cítrico a la solución de ácido cítrico. Esto hará que la solución de ácido cítrico sea más concentrada. Como hicieron antes, añadirán una gota de solución de ácido cítrico, pero esta vez la solución de ácido cítrico estará más concentrada.
Pide a los alumnos que hagan una predicción:
- ¿Cómo creen que cambiará el color si añaden una gota de una solución de ácido cítrico más concentrada al indicador universal en el siguiente pocillo?

Procedimiento
Probar una solución de ácido cítrico más concentrada
- Usando el palillo de dientes como cucharadita, añade otro poco de ácido cítrico al vaso con el ácido cítrico. Agita suavemente hasta que el ácido cítrico se disuelva.
- Añade 1 gota de esta solución de ácido cítrico más concentrada al tercer pocillo. Agita suavemente la solución con un palillo de dientes limpio.
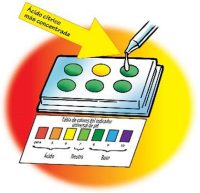
- Compara el color de la solución con el control y con la tabla de colores del indicador universal de pH. Registra el color del indicador, la cantidad de cucharaditas de ácido cítrico añadidas con el palillo de dientes y el número de pH en la tabla para el pocillo 3.
- Continúa añadiendo palillos de dientes con ácido cítrico y probando la solución en los últimos tres pocillos para ver cuántos colores distintos puedes obtener.
Resultados esperados
A medida que aumenta la concentración de la solución de ácido cítrico, el color debe cambiar a variaciones de verde amarillento, amarillo, naranja amarillento, naranja, rojo anaranjado y rojo. Los colores obtenidos variarán de un grupo a otro debido a las diferentes cantidades de ácido cítrico que los alumnos pueden recoger con el palillo de dientes. Los alumnos pueden obtener 4 o 5 colores diferentes. Las respuestas y los colores incluidos en la tabla siguiente variarán.
Color y pH de diferentes concentraciones de ácido cítrico | |||
| Número de pocillo | Número de cucharaditas de ácido cítrico utilizadas en 5 ml de agua | Color | pH |
1 | 0 | Verde | 7 |
2 | 1 | Verde amarillento | 6.5 |
3 | 2 | Amarillo | 6 |
4 | 3 | Naranja claro | 5.5 |
5 | 4 | Durazno | 5 |
6 | 5 | Rosa | 4 |
Pregunta a los alumnos:
- Cómo cambia el color de la solución indicadora a medida que aumenta la concentración de la solución de ácido cítrico?
A medida que aumenta la concentración de la solución de carbonato de sodio, el color pasa de verde a violeta en la tabla de color del pH - ¿Cómo cambia el número en la escala de pH a medida que aumenta la concentración de la solución de ácido cítrico?
A medida que aumenta la concentración de la solución de ácido cítrico (más ácida), el número en la escala de pH disminuye.
Paso 7
Pide a los alumnos que ensayen aumentar las concentraciones de solución de carbonato de sodio.
Nota: Las diferencias de color en el lado básico de la escala de pH para el indicador universal no son tan obvias como las del lado ácido. Los alumnos tendrán que buscar con más atención para detectar la diferencia entre verde azulado, azul, azul violáceo y violeta.
Pregunta para investigar
¿Cómo afecta la concentración de carbonato de sodio al color de la solución indicadora universal?
Materiales para cada grupo
- Solución indicadora universal
- Tabla de color de pH
- Solución de carbonato de sodio
- Al menos 6 palillos de dientes
- Platina
- 2 goteros
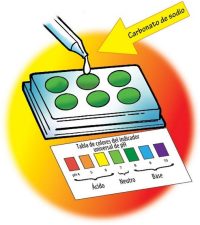
Procedimiento
Analiza la solución de carbonato de sodio
- Usa un gotero para llenar casi por completo los 6 pocillos de la otra platina con la solución indicadora universal. No añadirás nada más al primer pocillo.
- Añade 1 gota de solución de carbonato de sodio al segundo pocillo. Agita suavemente la solución con un palillo de dientes limpio.
- Compara el color de la solución con el control y con la tabla de colores del indicador universal de pH. Registra el color del indicador, la cantidad de palillos de dientes con carbonato de sodio utilizados para fabricar la solución y el número de pH en la tabla para el pocillo 2.
Resultados esperados
El color del indicador debe pasar a verde azulado o azul.
Pide a los alumnos que hagan una predicción:
- ¿Cómo creen que cambiará el color si añaden una gota de una solución más concentrada de carbonato de sodio al indicador universal en el pocillo siguiente?
Diles a los alumnos que si añades más base a la misma cantidad de agua, la concentración de la base aumentará.

Procedimiento
Analizar una solución de carbonato de sodio más concentrada
- Añade otro palillo de dientes con carbonato de sodio al vaso de carbonato de sodio. Agita suavemente hasta que el carbonato de sodio se disuelva.
- Añade 1 gota de solución de carbonato de sodio al siguiente pocillo. Mezcla suavemente el líquido con un palillo de dientes limpio.
- Compara el color del líquido con el control y con la tabla de colores del indicador universal de pH. Registra el color del indicador, la cantidad de palillos de dientes con carbonato de sodio utilizados y el número de pH en la tabla para el pocillo 3.
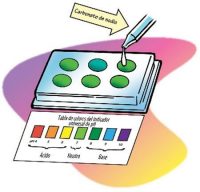
- Sigue añadiendo palillos de dientes con carbonato de sodio y prueba la solución en los últimos tres pocillos para ver cuántos colores o tonos diferentes puedes hacer.
Resultados esperados
La solución de carbonato de sodio más concentrada debe hacer que el color cambie a un azul más oscuro que se va tornando violeta. Las respuestas y los colores incluidos en la tabla siguiente variarán.
El color y el pH de diferentes concentraciones de carbonato de sodio | |||
Número de pocillo
| Cantidad de palillos de dientes de carbonato de sodio utilizados en 5 ml de agua | Color
| pH
|
1 | 0 | Verde | 7 |
2 | 1 | Verde azulado | 8 |
3 | 2 | Azul | 8.5 |
4 | 3 | Azul violáceo | 9 |
5 | 4 | Violeta | 9.5 |
6 | 5 | Violeta | 10 |
Pregunta a los alumnos:
- Cómo cambia el color de la solución indicadora a medida que aumenta la concentración de la solución de carbonato de sodio?
A medida que aumenta la concentración de la solución de carbonato de sodio, el color pasa de verde a violeta en la tabla de color del pH - ¿Cómo cambia el número en la escala de pH a medida que aumenta la concentración de la base?
A medida que aumenta la concentración de carbonato de sodio, la solución se vuelve más básica, por lo que aumenta el número en la escala de pH.
4 Explica
Paso 8
Explica cómo interactúan entre sí las moléculas de agua para formar iones.
Diles a los alumnos que el pH tiene que ver con la forma en que los ácidos y las bases interactúan con el agua. Explica que primero mostrarás a los alumnos cómo interactúan entre sí las moléculas de agua antes de añadir un ácido o una base.
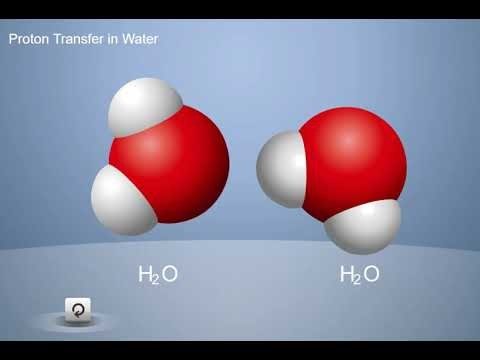
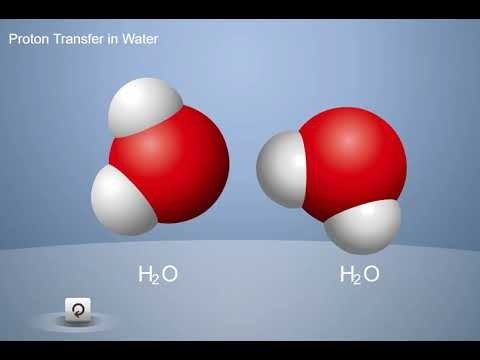
Proyecta la animación Transferencia de un protón en agua.
Reproduce la primera parte de la animación.
Recuerda a los alumnos que cada átomo de hidrógeno en una molécula de agua tiene un protón y un electrón. Los átomos de hidrógeno comparten sus electrones con el átomo de oxígeno.
Haga clic en “siguiente” para mostrar cómo las moléculas de agua se convierten en iones.
Las moléculas de agua se mueven continuamente y se chocan entre sí. A veces, cuando dos moléculas de agua se unen, un protón de un átomo de hidrógeno abandona su molécula de agua y se convierte en parte de otra molécula de agua. Solo el protón con carga positiva se mueve; el electrón con carga negativa se queda atrás. Por lo tanto, estas dos moléculas H2O se convierten en los iones H3O+ y OH−.
Haz clic en “siguiente” para mostrar cómo los iones se convierten en moléculas de agua nuevamente.
Explica que cuando estos iones se golpean entre sí, el protón de H3O+ puede moverse hacia el ion de OH-, formando dos moléculas de agua normales nuevamente. Dado que los protones van hacia adelante y hacia atrás entre las moléculas de agua o entre los iones de forma continua, siempre hay la misma cantidad de iones H3O+ y OH− en agua.
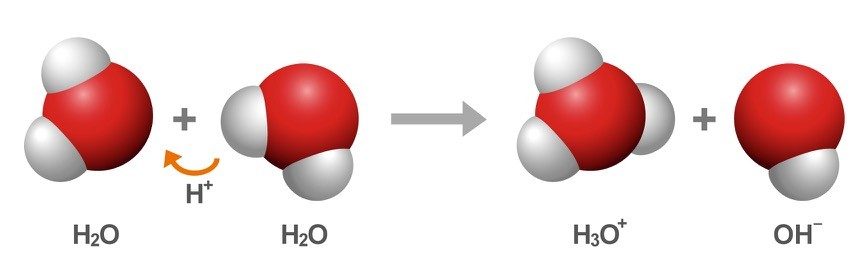
Proyecta la ilustración Las moléculas de agua intercambian protones.
Esta ilustración muestra las ecuaciones químicas que explican cómo las moléculas de agua pueden convertirse en iones y cómo los iones pueden convertirse de nuevo en moléculas de agua.
Explica a los alumnos que la primera ecuación química muestra dos moléculas de agua que se unen. Señala la fórmula química de cada molécula de agua, H2O.
- Explica la formación del ion H3O+
Después de que se transfiere el protón, la molécula de agua que ahora tiene el protón adicional se denomina ion H3O+. El motivo por el que la cantidad de átomos de hidrógeno cambió de dos (el subíndice en H2) a tres (el subíndice en H3) se debe a que tener un protón extra es como tener un átomo de hidrógeno extra, aunque el electrón no se haya transferido junto con aquel. Dado que se añadió un protón, hay un protón más que la cantidad de electrones, lo que lo convierte en un ion positivo. - Explica la formación del ion OH−
La molécula de agua que perdió un protón ahora tiene un electrón extra, por lo que se llama ion OH-. El motivo por el que la cantidad de átomos de hidrógeno cambió de dos (el subíndice en H2) a uno (que no haya subíndice después del H significa 1 hidrógeno) es porque perder un protón es como perder un átomo de hidrógeno. Dado que solo se transfirió el protón, hay un electrón más que la cantidad de protones, lo que lo convierte en un ion negativo.
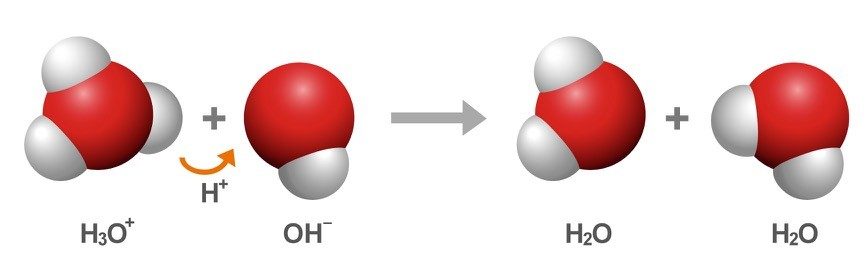
Diles a los alumnos que la segunda ecuación química muestra un ion H3O+ y un ion OH− uniéndose para convertirse de nuevo en moléculas de agua.
- Explica la reformación de dos moléculas H2O
Explica a los alumnos que las moléculas de agua y los iones siempre están colisionando. Cuando un ion H3O+ y un ion OH− se chocan entre sí, el protón puede transferirse del ion H3O+ al ion OH− de manera que cada ion se convierte de nuevo en una molécula H2O.
En cualquier momento en una muestra normal de agua, un pequeño porcentaje de moléculas de agua están transfiriendo protones y se están convirtiendo en iones. Además, los iones H3O+ y OH− transfieren protones y se convierten de nuevo en moléculas de agua.
Paso 9
Explica cómo los ácidos y las bases hacen que el indicador cambie de color.
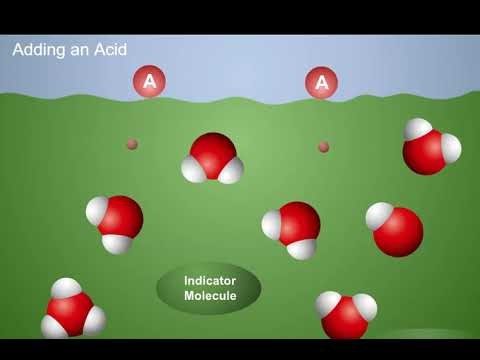
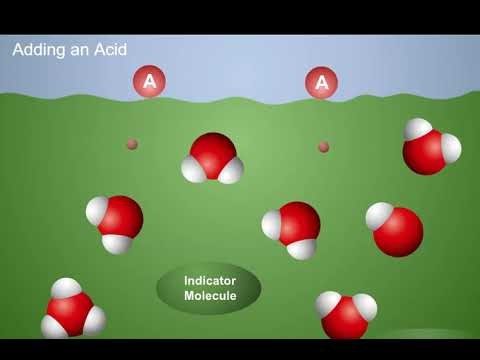
Proyecta la animación Los ácidos donan protones.
Diles a los alumnos que cuando se añade un ácido a una solución indicadora, el ácido dona protones a las moléculas de agua. Esto aumenta la concentración de iones H3O+ en la solución. Los iones H3O+ donan protones a las moléculas indicadoras, lo que hace que el indicador cambie de color y se torne rojo.
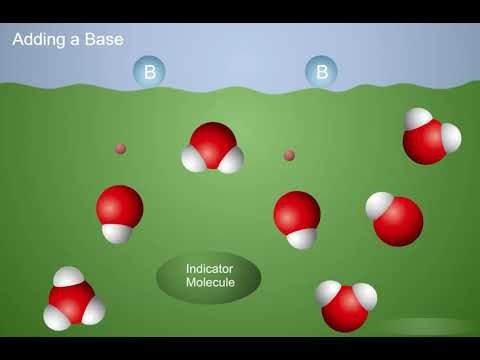
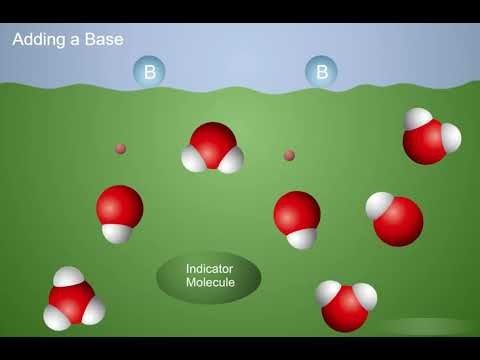
Proyecta la animación Las bases aceptan protones.
Cuando se añade una base a una solución indicadora, acepta protones de las moléculas de agua, creando iones OH−. Los iones H3O+ y las moléculas indicadoras donan protones a los iones OH-, lo que hace que el indicador cambie de color y se torne violeta.
Lee más sobre potencia frente a concentración en ácidos y bases en la Información contextual para el maestro.
- Lección 6.8 Información contextual para el maestro PDF
5 Amplía
Paso 10
Pide a los alumnos que viertan lentamente sus restantes soluciones ácidas y básicas en la solución indicadora para presentar la idea de que los ácidos y las bases pueden neutralizarse entre sí.
Pide a los alumnos que hagan una predicción:
- ¿Cómo creen que cambiará el color si vierten una pequeña cantidad de cada solución sobrante en la solución indicadora universal?
Materiales para cada grupo
- Solución indicadora universal
- Tabla de color de pH
- Solución de ácido cítrico
- Solución de carbonato de sodio

Procedimiento
- Vierte una pequeña cantidad de la solución de ácido cítrico o de la solución de carbonato de sodio en la solución indicadora. Agita y compara el color con la tabla universal de pH.
- Vierte una pequeña cantidad de la otra solución en la solución indicadora. Agita y compara el color con la tabla de colores.
- Sigue vertiendo pequeñas cantidades de las soluciones ácidas y básicas en el indicador hasta que se agoten las soluciones.
Resultados esperados
Los colores de la solución del indicador variarán, pero los alumnos deben ver que los ácidos y las bases mezclados hacen que el color del indicador cambie hacia el neutro.
Pide a los alumnos que describan lo que hicieron y sus observaciones. A continuación, explica que en el Capítulo 6, Lección 9, combinarán ácidos y bases en una solución indicadora con el objetivo de hacer que el pH de la solución final sea neutro.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Descargas
Para los estudiantes
- Lección 6.8 Hoja de actividades PDF | DOCX | Google Doc
- Tabla de colores del indicador universal de pH PDF
Para los maestros
- Lección 6.8 Plan de lección PDF | DOCX | Google Doc
- Lección 6.8 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
- Lección 6.8 Información contextual para el maestro PDF
Recursos para el Capítulo 6
- Capítulo 6 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 6 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda