Encontrar el volumen—el método de desplazamiento del agua
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- Un objeto sumergido desplaza un volumen de líquido igual al volumen del objeto.
- Un mililitro (1 ml) de agua tiene un volumen de 1 centímetro cúbico (1 cm3).
- Los diferentes átomos tienen diferentes tamaños y masas.
- Los átomos de la tabla periódica se ordenan de acuerdo con la cantidad de protones en el núcleo.
- Aunque un átomo sea más pequeño que otro átomo, puede tener más masa.
- La masa de los átomos, su tamaño y la forma en que están dispuestos determinan la densidad de una sustancia.
- La densidad es igual a la masa de la sustancia dividida por su volumen; D = m/v.
- Los objetos que tienen igual masa, pero diferentes volúmenes, tienen diferentes densidades.
Resumen
Los alumnos utilizan el método de desplazamiento del agua para encontrar el volumen de diferentes varillas que tienen la misma masa. Calculan la densidad de cada varilla y utilizan la densidad característica de cada material para identificar las cinco varillas. Luego, consideran la relación entre la masa, el tamaño y la disposición de los átomos para explicar por qué las diferentes varillas tienen diferentes densidades. Se les presentará brevemente a los alumnos la tabla periódica.
Objetivo
Los alumnos podrán explicar que los materiales tienen densidades características debido a la diferente masa, tamaño y disposición de sus átomos. Podrán usar el método de desplazamiento del volumen para encontrar el volumen de un objeto.

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas.
Materiales para cada grupo
- Conjunto de 5 varillas diferentes que tienen la misma masa
- Cilindro graduado, 100 ml
- Agua en un vaso
- Calculadora
Notas sobre los materiales:
Para esta lección se necesitará un juego de cinco varillas sólidas, cada una con la misma masa y el mismo diámetro, pero con un volumen diferente. Cada varilla está hecha de un material distinto. Existen diversas versiones de estas barras, disponibles de varios proveedores. Esta actividad utiliza el juego Equal Mass Kit de Flinn Scientific, pero se puede adaptar a cualquier juego de varillas de masa equitativa. Dado que solo hay cinco muestras en el Equal Mass Kit, es posible que se necesiten dos juegos para que cada grupo pueda trabajar con una muestra.
Esta tabla te ayudará a identificar cada varilla. No revele esta información a los estudiantes. Más adelante en esta lección descubrirán la identidad de cada varilla y la relación inversa entre la densidad y la longitud de cada varilla.
| Muestra | Material | Densidad aproximada (g/cm3) | Longitud relativa |
Metal más pequeño | Latón | 7.5 | más corta
más larga |
Metal gris brillante | Aluminio | 3.0 | |
Gris oscuro | PVC | 1.4 | |
Larga blanquecina | Nailon | 1.1 | |
Blanca más alta | Polietileno | 0.94 |
Descarga todos los recursos de la Lección 3.2
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 3.2: Encontrar el volumen—el método de desplazamiento del agua."
Instrucciones
1 Involúcrate
Paso 1
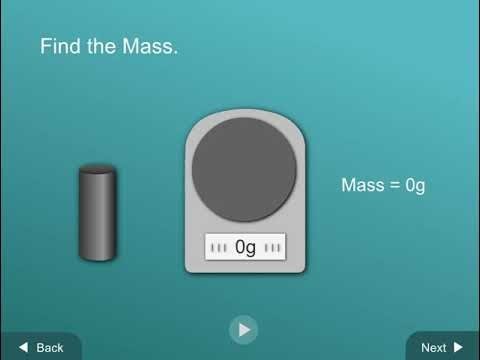
Muestra a los alumnos cinco varillas con la misma masa, pero volúmenes diferentes.
Muestra a los alumnos las cinco varillas y explica que todas tienen la misma masa. Luego, sostén la varilla más larga, la mediana y la corta, y recuérdales a los alumnos que todas tienen la misma masa.
Pide a los alumnos que hagan una predicción:
- ¿Qué varilla es la más densa? ¿La menos densa? ¿La de masa intermedia?
Es posible que los alumnos piensen que, dado que la masa de cada varilla es la misma, el volumen de cada varilla debe tener algo que ver con su densidad. Algunos pueden llegar a decir que la varilla con el volumen más pequeño debe tener la densidad más alta, porque la misma cantidad de masa se aprieta en un volumen más pequeño. O que la varilla con el volumen más grande debe tener la densidad más baja, debido a que la misma masa se extiende por un volumen mayor.
Diles a los alumnos que, al igual que los cubos de la actividad anterior, deberán conocer el volumen y la masa de cada una de las muestras. También calcularán la densidad de cada muestra y usarán este valor para determinar de qué material se compone cada varilla.
Paso 2
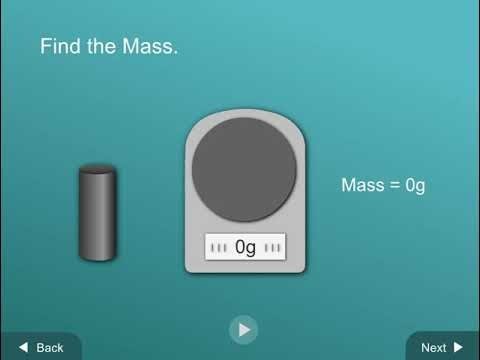
Muestra una animación y haz una demostración sobre cómo medir el volumen usando el método de desplazamiento del agua.
Proyecta la animación Desplazamiento del agua.
Reproduce la animación mientras haces una demostración del método de desplazamiento del agua usando un vaso de agua, un cilindro graduado y una varilla, del modo en que los alumnos lo harán cuando realicen la actividad. Usa la muestra de plástico gris oscuro para que los alumnos puedan verlo mejor.
Volumen
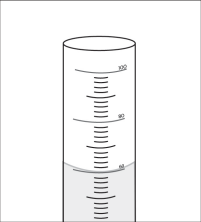
- Haz una demostración de lo que los alumnos deberán hacer, vertiendo agua de un vaso en un cilindro graduado de 100 ml hasta que alcance una altura que cubra la muestra. Este es el “nivel de agua inicial.”
- Diles a los alumnos que la superficie del agua en un tubo puede no ser completamente plana. En cambio, la superficie puede curvarse con la forma de una U poco profunda, denominada menisco. Al realizar la medición, lee la línea justo en la parte inferior del menisco.

- Inclina levemente el cilindro graduado y desliza cuidadosamente la muestra en el agua. Sostén el cilindro graduado en posición vertical. Registra el nivel de agua. Señala que este es el “nivel final de agua.”
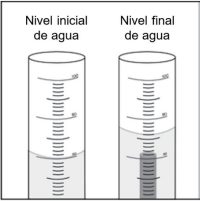
- Diles a los alumnos que desean averiguar cuánto cambió el nivel del agua. Resta el nivel inicial de agua del nivel final de agua para encontrar el volumen de la varilla.
Volumen de la muestra = nivel final de agua – nivel inicial de agua
Los alumnos pueden confundirse con el hecho de que la unidad para el volumen en el cilindro graduado sea mililitros (ml), cuando en la lección anterior calcularon el volumen en centímetros cúbicos (cm3). Explica a los alumnos que 1 ml es igual a 1 cm3. Haz clic en el botón con forma ovalada en la primera pantalla de la animación, marcado con “1 ml = 1 cm3”.
Pregunta a los alumnos:
- Cuando se coloca una muestra en el agua, ¿por qué aumenta el nivel del agua?
El volumen que ocupa la varilla empuja o desplaza el agua. El único lugar adonde puede ir el agua es hacia arriba. La cantidad o el volumen de agua desplazado son iguales al volumen de la muestra. - ¿El volumen de la muestra es igual al nivel final de agua?
No. Los alumnos deben darse cuenta de que el volumen de la varilla no es igual al nivel del agua en el cilindro graduado. En cambio, el volumen de la varilla es igual a la cantidad de agua que subió en el cilindro graduado (la cantidad desplazada). Para encontrar la cantidad de agua desplazada, los alumnos deben restar el nivel inicial de agua (60 ml) del nivel final de agua. - ¿Qué unidades se deben usar al registrar el volumen de la muestra?
Debido a que utilizarán el volumen para calcular la densidad, los alumnos deben registrar el volumen de la muestra en cm3.
Masa
Los grupos de alumnos no deberán medir la masa de las varillas. La masa de cada varilla es la misma, 15 gramos, y aparece en tu tabla de la hoja de actividades. Deberán medir el volumen de cada una de las cinco varillas diferentes y calcular sus densidades. Los alumnos usarán sus valores de densidad a fin de identificar cada varilla.
Densidad
Demostrar cómo calcular la densidad (D = m/v) dividiendo la masa por el volumen. Señala que la respuesta estará en gramos por centímetro cúbico (g/cm3).
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 3.2 Hoja de actividades PDF | DOCX | Google Doc
- Lección 3.2 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Mira la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
Da a los alumnos tiempo para responder las preguntas 1 a 5 de la hoja de actividades antes de comenzar la actividad.
3 Explora
Paso 3
Pide a los alumnos que calculen la densidad de cinco varillas diferentes y que usen la propiedad característica de la densidad para identificarlos correctamente.
Nota: Las densidades de los tres plásticos son similares, por lo que los alumnos deben ser muy cuidadosos al medir su volumen utilizando el método de desplazamiento del agua. Además, es difícil medir el volumen de la varilla más pequeña. Da a los alumnos una pista de que está entre 1.5 y 2.0 ml.
Pregunta para investigar
¿Puedes usar la densidad para identificar las cinco varillas?
Materiales para cada grupo
- Juego de cinco varillas diferentes que tienen la misma masa
- Cilindro graduado, 100 ml
- Agua en un vaso
- Calculadora
Preparación del maestro
- Usa un marcador permanente para marcar las cinco varillas con las letras A, B, C, D y E. Mantén un registro de qué letra corresponde a cada muestra sin informar a los alumnos. Si utilizas dos o más juegos de varillas, asegúrate de marcar cada muestra del mismo material con la misma letra.
- Después de que un grupo encuentre el volumen de una muestra, debe pasar esa muestra a otro grupo hasta que todos los grupos hayan encontrado el volumen de las cinco varillas.
- Para la muestra más larga, que flota, los alumnos pueden usar un lápiz para empujar suavemente la muestra para que quede justo debajo de la superficie del agua para medir su volumen completo.
Procedimiento
Volumen
- Vierte suficiente agua de tu taza en el cilindro graduado para alcanzar una altura que cubra la muestra. Lee y registra el volumen.
- Inclina levemente el cilindro graduado y coloca cuidadosamente la muestra en el agua.

- Coloca el cilindro graduado en posición vertical sobre la mesa y observa el nivel del agua.
Si la muestra flota, usa un lápiz para empujar suavemente la parte superior de la muestra para que quede justo debajo de la superficie del agua. Registra la cantidad de mililitros para este nivel final de agua. - Para encontrar la cantidad de agua desplazada, resta el nivel inicial de agua del nivel final. Este volumen equivale al volumen del cilindro en cm3.
- Registra este volumen en la tabla de la hoja de actividades.
- Retira la muestra vertiendo el agua nuevamente en el vaso y extrae la muestra del cilindro graduado.
Densidad
- Calcula la densidad usando la fórmula D = m/v. Registra la densidad en (g/cm3).
- Intercambia las muestras con otros grupos hasta que hayas medido el volumen y calculado la densidad de las cinco muestras.
Muestra | Nivel inicial de agua (ml) | Nivel final de agua (ml) | Volumen de las varillas (cm3) | Masa (g) | Densidad (g/ cm3) |
A |
|
|
| 15.0 |
|
B |
|
|
| 15.0 |
|
C |
|
|
| 15.0 |
|
D |
|
|
| 15.0 |
|
E |
|
|
| 15.0 |
|
Identifica las muestras
- Compara los valores de densidad que calculaste con los valores de la tabla. Luego, escribe el nombre de la letra para cada muestra en la tabla.
Nota: Es posible que las densidades calculadas por los alumnos no sean exactamente las mismas que las densidades dadas en la tabla. A medida que los alumnos trabajan, verifica sus valores de volumen para asegurarte de que estén usando la diferencia entre los niveles de agua final e inicial, no solo el nivel final.
Material | Densidad aproximada (g/ cm3) | Muestra (letras A a E) |
Latón | 8.8 |
|
Aluminio | 2.7 |
|
PVC | 1.4 |
|
Nailon | 1.2 |
|
Polietileno | 0.94 |
|
Paso 4
Analiza si los valores de densidad encontrados por los alumnos respaldan sus predicciones desde el comienzo de la lección.
Analiza los valores de densidad de cada una de las muestras en los alumnos. Señala que los diferentes grupos pueden tener valores diferentes de densidad, pero que la mayoría de los valores son parecidos a los valores de la tabla.
Pregunta a los alumnos:
- Cada grupo midió el volumen de las mismas muestras. ¿Por qué motivos los grupos pueden tener valores diferentes de densidad?
Los alumnos deben darse cuenta de que las pequeñas inexactitudes en la medición del volumen pueden explicar las diferencias en los valores de densidad. Otro motivo es que el cilindro graduado, en sí mismo, no es perfecto. Por lo tanto, siempre habrá cierta incertidumbre en la medición.
Recuerda a los alumnos que, al comienzo de la lección, hicieron una predicción sobre la densidad de la muestra pequeña, la muestra mediana y la muestra grande. Los alumnos deben haber predicho que el cilindro más grande tiene la densidad más baja, el cilindro más corto tiene la densidad más alta y el mediano se encuentra en un punto intermedio.
Pregunta a los alumnos:
- ¿Fue correcta su predicción sobre la densidad de estas tres muestras?
Pide a los alumnos que miren su tabla con los valores de masa, volumen y densidad de cada cilindro. Pide que busquen una relación entre el volumen y la densidad. Los alumnos deben darse cuenta de que el cilindro más corto tiene la mayor densidad y el cilindro más largo tiene la densidad más baja. - ¿Es acertado decir que si dos muestras tienen la misma masa, la que tiene el volumen mayor tendrá una densidad menor?
Sí. - ¿Por qué?
Debido a que las muestras tienen la misma masa, sus volúmenes darán una idea de sus densidades de acuerdo con la ecuación D = m/v. Si hay un número mayor para el volumen en el denominador, la densidad será menor. - ¿Es acertado decir que la que tenga el volumen más pequeño tendrá una densidad más alta?
Sí. - ¿Por qué?
Si hay un número menor para el volumen en el denominador, la densidad será mayor.
4 Explica
Paso 5
Pide a los alumnos que miren el tamaño y la masa de los átomos para ayudar a explicar por qué cada muestra tiene una densidad diferente.
Proyecta la imagen Tamaño atómico y masa.
Diles a los alumnos que esta tabla se basa en la tabla periódica de los elementos, pero que, de 118, solo incluye los primeros 20 elementos. Se muestra una representación de un átomo para cada elemento. Para cada elemento, el número atómico está encima del átomo y la masa atómica está debajo. Esta tabla es especial porque muestra el tamaño y la masa de los átomos en comparación con otros átomos.
Nota: Es posible que los alumnos quieran saber más acerca de por qué los átomos tienen números atómicos y tamaños diferentes. Estas preguntas se abordarán en capítulos posteriores, pero puedes decirles que el número atómico es la cantidad de protones en el centro o núcleo del átomo. Cada elemento tiene un cierto número de protones en sus átomos, por lo que cada elemento tiene un número atómico diferente. La diferencia de tamaño es un poco más difícil de explicar. Los átomos tienen protones con carga positiva en el núcleo y electrones con carga negativa que se mueven alrededor del núcleo. El espacio que ocupan los electrones es, en realidad, lo que constituye la mayor parte del tamaño del átomo. A medida que aumenta la cantidad de protones en el átomo, aumentan tanto su masa como la fuerza de su carga positiva. Esta carga positiva extra atrae los electrones al núcleo, haciendo que el átomo sea más pequeño. Los átomos se agrandan nuevamente en la siguiente fila porque se agregan más electrones en un espacio (nivel de energía) más alejado del núcleo.
Informa a los alumnos que en el Capítulo 4 aprenderán más sobre la tabla periódica y los átomos. Por ahora, todos los alumnos deben enfocarse en el tamaño y la masa de los átomos.
Diles a los alumnos que la diferencia de densidad entre las muestras pequeña, mediana y grande que midieron se puede explicar en función de los átomos y las moléculas de los que se componen.
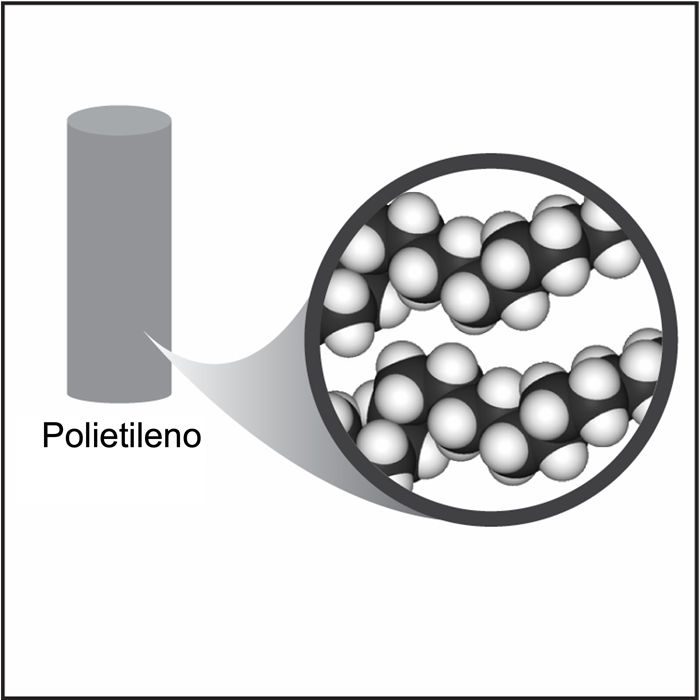
Proyecta la imagen Polietileno (varilla más larga).
El polietileno está hecho de moléculas largas compuestas solo por átomos de carbono e hidrógeno. En la tabla tamaño atómico y masa, la masa del carbono es bastante baja, y la masa del hidrógeno es la más baja de todos los átomos. Estas masas bajas ayudan a explicar por qué el polietileno tiene una baja densidad. Otro motivo es que estas moléculas largas y pequeñas no están muy apretadas entre sí.
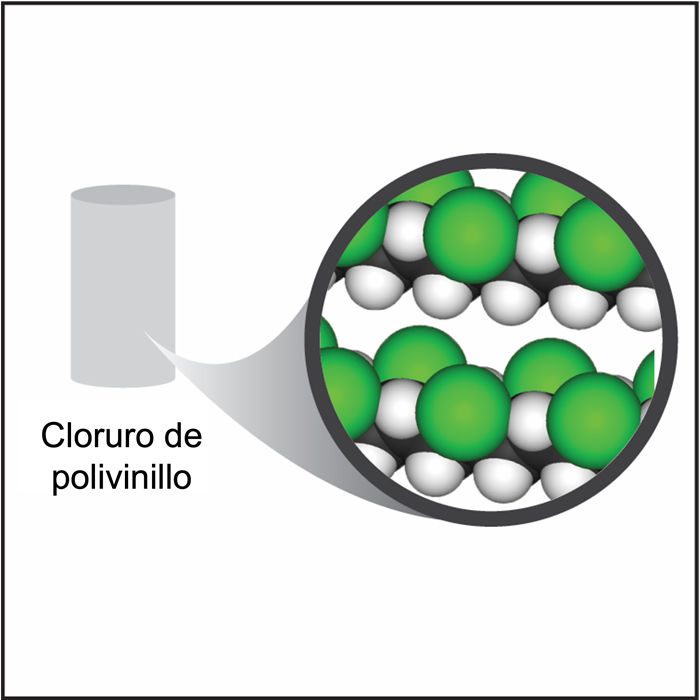
Proyecta la imagen cloruro de polivinilo (varilla de longitud media).
El cloruro de polivinilo también está compuesto por átomos de carbono, hidrógeno y cloro. Si comparamos el cloruro de polivinilo con el polietileno, notaremos que hay átomos de cloro en algunos lugares donde en el polietileno hay átomos de hidrógeno. Al mirar la tabla, el cloro tiene una masa que es grande para su tamaño. Esto ayuda a que el cloruro de polivinilo sea más denso que el polietileno. La densidad de los diferentes plásticos generalmente es causada por los diferentes átomos que pueden conectarse a las cadenas de carbono-hidrógeno. Si son átomos pesados para su tamaño, el plástico tiende a ser más denso; si son livianos para su tamaño, el plástico tiende a ser menos denso.
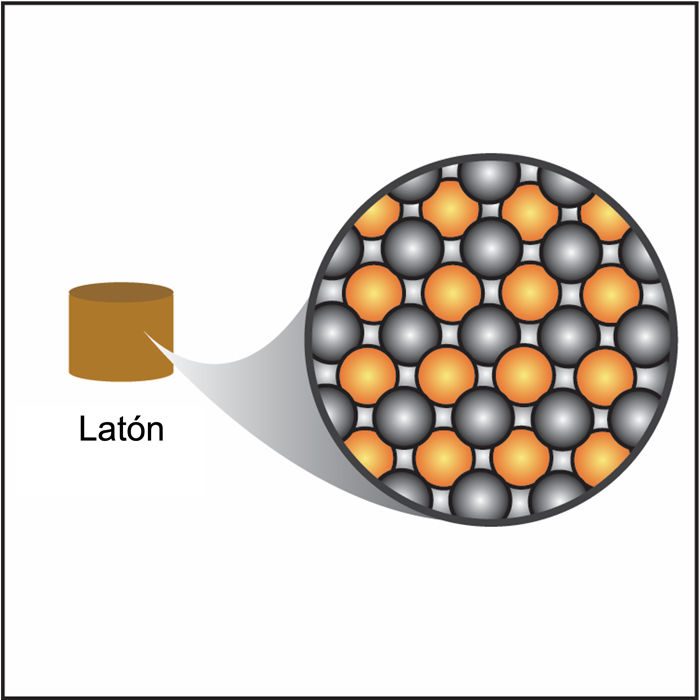
Proyecta la imagen bronce (varilla más corta).
El latón es una combinación de átomos de cobre y zinc. El cobre y el zinc aparecen más adelante en la tabla periódica, por lo que no se muestran en la tabla, pero ambos son pesados para su tamaño. Sus átomos también están muy apretados. Por estos motivos, el latón es más denso que el polietileno o el cloruro de polivinilo.
5 Amplía
Paso 6
Analiza la densidad del calcio en comparación con la densidad del azufre.
Pide a los alumnos que consulten la ilustración del calcio y el azufre en sus hojas de actividades. Explica que un átomo de calcio es más grande y más pesado que un átomo de azufre. Pero un trozo de azufre sólido es más denso que un trozo sólido de calcio. La densidad del azufre es de aproximadamente 2 g/cm3 y la densidad del calcio es de aproximadamente 1.5 g/cm3.
Pregunta a los alumnos:
- En función de lo que saben sobre el tamaño, la masa y la disposición de los átomos, expliquen por qué una muestra de azufre es más densa que una muestra de calcio.
Si bien un átomo de azufre tiene menos masa que un átomo de calcio, muchos más átomos de azufre pueden agruparse en una determinada cantidad de espacio. Esto da al azufre más masa por volumen que el calcio, lo que lo hace más denso.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Descargas
Para los estudiantes
- Lección 3.2 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 3.2 Plan de lección PDF | DOCX | Google Doc
- Lección 3.2 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Recursos para el Capítulo 3
- Capítulo 3 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 3 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda