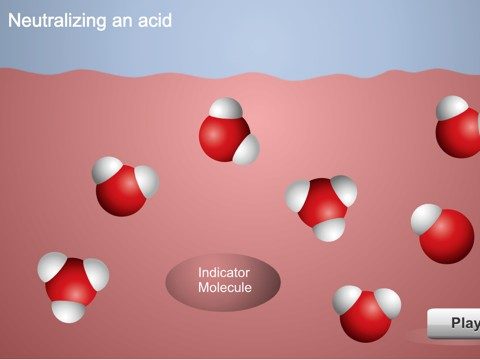
Neutralizar ácidos y bases
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- El pH es una medida de la concentración de iones H3O+ en una solución.
- Agregar un ácido aumenta la concentración de iones H3O+ en la solución.
- Agregar una base disminuye la concentración de iones H3O+ en la solución.
- Un ácido y una base son como opuestos químicos.
- Si se añade una base a una solución ácida, la solución se vuelve menos ácida y se mueve hacia el centro de la escala de pH. Esto se denomina neutralización del ácido.
- Si se añade un ácido a una solución básica, esta se vuelve menos básica y se mueve hacia el centro de la escala de pH. Esto se denomina neutralización de la base.
Resumen
Los alumnos utilizarán soluciones de ácido cítrico y de carbonato de sodio para comprobar que añadir una base a una solución ácida hace que la solución sea menos ácida. A continuación, los alumnos utilizarán una base para ayudarles a identificar cuál de las dos soluciones ácidas es más concentrada.
Objetivo
Los alumnos podrán explicar, a nivel molecular, que el pH se ve afectado por la concentración de los iones H3O+ en agua. También podrán explicar por qué añadir una base a un ácido o un ácido a una base puede hacer que el pH de la solución se acerque a 7.

Seguridad
Asegúrate de que tú y tus alumnos lleven gafas de seguridad apropiadas durante la actividad y de que se laven las manos después de ella. El carbonato de sodio puede irritar la piel. El ácido cítrico es un irritante ocular. El indicador universal es a base de alcohol e inflamable. Lee y sigue todas las advertencias de seguridad de la etiqueta. Al final de la lección, pide a los alumnos que viertan sus soluciones usadas en un contenedor de residuos. Desecha estos residuos por el desagüe o de acuerdo con la normativa local. Los restos de polvo de ácido cítrico y de carbonato de sodio se pueden desechar en el cesto de basura de la clase.
Materiales para la demostración
- 4 vasos de plástico transparente
- Cilindro graduado
- Solución indicadora universal
- Agua
- Carbonato de sodio
- Ácido cítrico
- Palillos de dientes planos
- 2 goteros
- Cinta de enmascarar y bolígrafo o marcador permanente
Materiales para cada grupo
- Solución indicadora universal en un vaso
- Ácido cítrico en un vaso
- Carbonato de sodio en un vaso
- Agua
- Solución A, solución de carbonato de sodio
- Solución B, solución de carbonato de sodio más concentrada
- Al menos 8 palillos de dientes planos
- Cilindro graduado
- Platina
- 4 goteros
- 3 vasos de plástico transparente
- Cinta de enmascarar y bolígrafo o marcador permanente
Acerca de los materiales
Cada grupo necesitará solución indicadora universal, ácido cítrico (anhidro) y carbonato de sodio (anhidro; para uso en laboratorio). Cada grupo necesitará una platina de 6 pocillos o una platina de 12 pocillos.
Descarga todos los recursos de la Lección 6.9
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 6.9: Neutralizar ácidos y bases."
Instrucciones
1 Involúcrate
Paso 1
Haz una demostración para mostrar a los alumnos que una solución ácida se vuelve menos ácida cuando se añaden gotas de una base.
Materiales para la demostración
- 4 vasos de plástico transparente
- Cilindro graduado
- Indicador universal
- Agua
- Carbonato de sodio
- Ácido cítrico
- Palillos de dientes planos
- 2 goteros
- Cinta de enmascarar y bolígrafo o marcador permanente
Preparación del maestro
Haz una solución indicadora para los grupos de alumnos
- Prepara una solución indicadora universal diluida para esta demostración y para cada grupo de alumnos combinando 125 ml de agua con 5 ml de solución indicadora universal.
- Vierte unos 15 ml de esta solución indicadora universal diluida en un vaso limpio para cada grupo de alumnos.
Nota: Es probable que el agua corriente de tu zona sea apropiada para la demostración y las actividades de esta lección. Si la solución indicadora que generas no es verde, significa que el agua es ácida o básica. Si esto sucede, utiliza agua destilada, que se vende en supermercados y farmacias.
Nota: En las actividades “Involúcrate” y “Ampliar”, los alumnos llenarán 6 pocillos con solución indicadora universal. Verifica que 15 ml de solución sean suficientes. Necesitarás unos 25 ml de solución indicadora para la demostración. Si 125 ml de solución no son suficientes, prepara más utilizando las mismas proporciones.
Preparación para la demostración
- Divide la solución indicadora restante en dos vasos de plástico transparente para usarlas en la demostración.
- Usa cinta de enmascarar y un bolígrafo para etiquetar dos vasos vacíos con el nombre “ácido cítrico” y “carbonato de sodio”.
- Usa el cilindro graduado para añadir 5 ml de agua a cada vaso etiquetado.
- Usa un palillo de dientes plano para recoger tanto ácido cítrico como puedas en el extremo del palillo de dientes, como se muestra. Añade este ácido cítrico al agua del vaso con ácido cítrico. Agita suavemente hasta que el ácido cítrico se disuelva.
- Usa un palillo de dientes plano para recoger tanto carbonato de sodio como puedas en el extremo del palillo de dientes. Añade este carbonato de sodio al agua en el vaso de carbonato de sodio. Agita suavemente hasta que el carbonato de sodio se disuelva.
Procedimiento
- Levanta los dos vasos de solución indicadora universal, que son de color verde.
- Muestra también a los alumnos que tienes una solución de ácido cítrico y una solución de carbonato de sodio.
Pregunta a los alumnos:
- ¿A qué color cambiará la solución indicadora verde si añado unas gotas de solución de ácido cítrico?
La solución indicadora cambiará de color y se tornará rojo.
Procedimiento
- Añade de 3 a 5 gotas de solución de ácido cítrico a uno de los vasos.
Resultados esperados
El color de la solución debe cambiar de verde a rojizo.
Pregunta a los alumnos:
- ¿Qué creen que podrían añadir al indicador rojizo para que sea menos ácido y vuelva al color verde?
Los alumnos deben sugerir añadir carbonato de sodio (una base) a la solución ácida (roja).

Procedimiento
- Sujetando el vaso de solución indicadora rojiza, añade 1 gota de solución de carbonato de sodio, mezcla y compara el color de la solución con el color del control.
- Añade otra gota si es necesario para acercarte al color verde del control. Continúa añadiendo gotas hasta que el color se aproxime al verde. Si añades una gota y el color pasa del verde al azul, pregunta a los alumnos qué es lo que les dice el color azul sobre la solución. El azul indica que la solución ha pasado de ser ácida a básica.
Explica que los ácidos y las bases son como opuestos químicos. Diles a los alumnos que realizarán un experimento para averiguar cuántas gotas de una solución básica se necesitan para que una solución ácida pase a la mitad de la escala de pH. Esto se denomina neutralización del ácido.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 6.9 Hoja de actividades PDF | DOCX | Google Doc
- Lección 6.9 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
Descarga la hoja de actividades del alumno y distribuye una por alumno cuando se especifique en la actividad. La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Para encontrar las respuestas a la hoja de actividades, ve al área de descargas de la versión en línea de esta lección.
3 Explora
Paso 2
Pide a los alumnos que preparen las soluciones para la actividad.
Preparación del maestro
Los alumnos necesitarán pequeñas cantidades de carbonato de sodio y de ácido cítrico para la actividad.
- Etiqueta dos vasos de plástico pequeños con los nombres “solución de ácido cítrico” y “solución de carbonato de sodio” para cada grupo.
- Coloca aproximadamente 1⁄4 de cucharadita de ácido cítrico y de carbonato de sodio en los vasos etiquetados.
- Distribuye los vasos con solución indicadora universal a cada grupo de alumnos.
Materiales para cada grupo
- Carbonato de sodio en un vaso
- Ácido cítrico en un vaso
- Indicador universal en un vaso
- Agua
- 3 vasos de plástico transparente
- Cilindro graduado
- Palillos de dientes planos
- 2 goteros
- Platina
- Cinta de enmascarar y bolígrafo o marcador permanente

Procedimiento
Etiqueta tu equipo
- Utiliza cinta de enmascarar y un bolígrafo para etiquetar un vaso con el nombre “solución de ácido cítrico” y otro vaso “solución de carbonato de sodio”.
- Utiliza un pequeño trozo de cinta de enmascarar y un bolígrafo para etiquetar un gotero con el nombre “solución de ácido cítrico” y otro “solución de carbonato de sodio”.

Crea una solución de ácido cítrico
- Usa el cilindro graduado para añadir 5 ml de agua al vaso con la etiqueta de ácido cítrico.
- Usa un palillo de dientes plano para recoger tanto ácido cítrico como puedas en el extremo del palillo de dientes, como se muestra.
- Añade este ácido cítrico al agua del vaso con ácido cítrico. Agita suavemente hasta que el ácido cítrico se disuelva.
Crear una solución de carbonato de sodio
- Utiliza el cilindro graduado para añadir 5 ml de agua al vaso etiquetado como carbonato de sodio.
- Usa un palillo de dientes plano para recoger tanto carbonato de sodio como puedas en el extremo del palillo de dientes.
- Añade este carbonato de sodio al agua en el vaso de carbonato de sodio. Agita suavemente hasta que el carbonato de sodio se disuelva.
Paso 3
Haz que los alumnos neutralicen una solución ácida.
Pregunta para investigar
¿Cuántas gotas de solución de carbonato de sodio se necesitarán para neutralizar la solución de ácido cítrico?
Materiales para cada grupo
- Solución indicadora universal
- Solución de ácido cítrico
- Solución de carbonato de sodio
- Al menos 6 palillos de dientes planos
- Platina
- 3 goteros
Procedimiento
- Usa un gotero para llenar casi por completo 2 pocillos pequeños de la platina con la solución indicadora universal. No añadas nada más al primer pocillo. Este será el control.
- Añade 3 gotas de solución de ácido cítrico al indicador en uno de los pocillos. Utiliza un palillo de dientes limpio para mezclar la solución. Si no está rojiza, añade más gotas, pero asegúrate de contar la cantidad total de gotas que añadas.
Pregunta a los alumnos:
- ¿Qué podrían añadir para que la solución indicadora sea menos ácida?
Añadir una base, como la solución de carbonato de sodio, hará que la solución sea menos ácida. - ¿Deben añadir una gota de solución de carbonato de sodio por vez o algunas gotas todas juntas?
Deben añadir una gota por vez para controlar mejor cuántas gotas más de la solución de carbonato de sodio deben añadirse. - ¿Cómo sabrán cuándo se neutraliza la solución?
El color de la solución será similar al color del control. Diles a los alumnos que si la solución se vuelve azul, ha pasado de ser un ácido, luego a neutro y ahora es una base. Si esto sucede, intenta añadir una o más gotas de ácido cítrico hasta que el color sea casi neutro. Asegúrate de llevar un registro de la cantidad total de gotas de ácido y base que se añaden.
- Añade gotas individuales de carbonato de sodio al mismo pocillo en el que añadiste el ácido. Asegúrate de contar las gotas que añadas y mezcla con un palillo de dientes después de añadir cada gota.
Resultados esperados
Con cada gota de carbonato de sodio, la solución de ácido cítrico se desplazará hacia una posición neutra y, con el tiempo, se volverá verde.
Nota: La solución puede acercarse al color verde del control, pero probablemente no sea exacta. Esto se debe a que las soluciones de ácido cítrico y de carbonato de sodio no son exactamente iguales en cuanto a su forma de actuar como ácido y base. Además, para ser muy exactos, los alumnos tendrían que poder utilizar medias gotas o incluso cuartos de gota, algo que no es posible con los goteros que utilizan los alumnos. Mientras los alumnos vean una tendencia hacia el color verde del control, será suficiente.
¿Cuántas gotas de carbonato de sodio se necesitan para neutralizar la solución de ácido cítrico? | ||
| Solución ácida | Cantidad de gotas de solución de ácido cítrico añadidas al indicador | Cantidad de gotas de solución de carbonato de sodio necesarias para neutralizar la |
Primera solución de ácido cítrico | 3 gotas |
|
Solución de ácido cítrico más concentrada |
|
|
Paso 4
Analiza las observaciones de los alumnos.
- ¿Cuántas gotas de carbonato de sodio se necesitaron para llevar el color al color del control?
Los resultados variarán, pero se necesitarán menos gotas de carbonato de sodio que gotas de ácido cítrico para neutralizar la solución. - ¿La solución se vuelve más ácida o menos ácida a medida que se añade cada gota de carbonato de sodio al indicador?
La solución se vuelve menos ácida. - ¿Cómo utilizas el color del control para ayudarte a neutralizar un ácido?
Cuando el color de la solución indicadora universal se vuelve casi verde, la solución ácida se ha neutralizado.
4 Explica
Paso 5
Explica cómo agregar una base a una solución ácida afecta la concentración de iones H3O+.
Proyecta la animación Neutralizar una solución ácida.
Explica a los alumnos que añadir gotas de ácido cítrico a la solución indicadora aumentó la concentración de iones H3O+. Cuando añades una base a esta solución ácida, la base acepta protones de las moléculas de agua que crean iones OH−. Los iones H3O+ y las moléculas del indicador donan protones a los iones OH−. Cuando se añade suficiente base como para que la concentración de iones H3O+ y OH− sea igual, la solución se neutraliza.
5 Explora
Paso 6
Haz que los alumnos comparen cuántas gotas más de una base se necesitan para neutralizar una solución ácida más concentrada.
Pregunta para investigar
¿Cuántas gotas más de solución de carbonato de sodio se necesitarán para neutralizar una solución de ácido cítrico más concentrada?
Materiales para cada grupo
- Ácido cítrico
- Solución de ácido cítrico
- Solución de carbonato de sodio
- Solución indicadora universal
- 2 palillos de dientes planos
- 3 goteros
- Platina

Procedimiento
Neutraliza una solución de ácido cítrico
- Utiliza un palillo de dientes plano para añadir dos cucharaditas de ácido cítrico a la solución de ácido cítrico para que sea aún más ácida. Agita suavemente hasta que el ácido cítrico se disuelva.
- Añade solución indicadora universal a un pocillo limpio en la platina.
- Añade 3 gotas de la solución de ácido cítrico más concentrada al indicador y mezcla con un palillo limpio.
Pregunta a los alumnos:
- ¿Creen que se necesitará más, menos o la misma cantidad de solución de carbonato de sodio para neutralizar esta solución de ácido cítrico más concentrada?
Se necesitarán más gotas de la base para neutralizar la solución de ácido cítrico más concentrada. - Pensando en la animación, ¿por qué necesitarán más gotas de solución de carbonato de sodio?
Dado que la solución es más ácida, hay más iones H3O+. Por lo tanto, se necesitan más moléculas de la base para aceptar los protones adicionales y moverse hacia una posición neutra.
Procedimiento
Neutraliza una solución de ácido cítrico más concentrada
- Añade gotas individuales de la solución de carbonato de sodio al mismo pocillo en el que añadiste el ácido. Asegúrate de contar las gotas que añadas y mezcla con un palillo de dientes después de añadir cada gota. Registra esta cifra en la tabla.
6 Amplía
Paso 7
Pide a los alumnos que neutralicen dos soluciones básicas para determinar cuál es la más concentrada.
Materiales para cada grupo
- Solución indicadora universal
- Solución de ácido cítrico
- Solución A
- Solución B
- Al menos 6 palillos de dientes
- Platina
- 3 goteros
Preparación del maestro
- Haz dos soluciones misteriosas utilizando cantidades diferentes de carbonato de sodio.
- Etiqueta dos vasos con el nombre “solución A” y “solución B” para cada grupo.
- Haz un conjunto de soluciones A y B para la clase.
- Solución A: 50 ml de agua y 5 cucharaditas de carbonato de sodio tomadas con un palillo de dientes
- Solución B: 50 ml de agua y 10 cucharaditas de carbonato de sodio tomadas con un palillo de dientes
- Coloca unos 5 ml de cada solución en los vasos etiquetados respectivos.
Pregunta a los alumnos:
- Las soluciones A y B son soluciones básicas fabricadas con carbonato de sodio y agua. Una de estas soluciones tiene más carbonato de sodio que la otra. ¿Cómo pueden averiguar qué solución está más concentrada?
Los alumnos deben describir un procedimiento muy similar al que utilizaron para neutralizar las dos soluciones de ácido cítrico. Deben sugerir neutralizar cada solución de carbonato de sodio con gotas de ácido cítrico y contar cuántas gotas se necesitan para neutralizar cada solución. Cuando el color de la solución es cercano al color del control, la solución se neutraliza. - ¿Cómo sabrán qué solución es la más concentrada?
La solución que requiera la mayor cantidad de gotas de ácido cítrico para volverse neutra será la más básica.
Comenta lo que harán los alumnos:
- Para obtener los mejores resultados, pide a los alumnos que coloquen 2 gotas de solución A en un pocillo bien lleno con solución indicadora y 2 gotas de solución B en otro pocillo bien lleno con solución indicadora.
- A continuación, deben añadir gotas individuales de solución de ácido cítrico, agitar y comparar el color con el color del control.
- Los alumnos deben hacer un seguimiento de la cantidad de gotas de ácido cítrico necesarias para neutralizar cada solución.
Procedimiento
- Añade solución indicadora universal a tres pocillos limpios en la platina.
- No toques el primer pocillo para que se pueda utilizar como control. Añade 2 gotas de solución A al segundo pocillo.
- Añade 2 gotas de solución B al tercer pocillo.
¿Qué solución es la más concentrada? | ||
Solución | Cantidad de gotas de solución añadidas al indicador | Cantidad de gotas de solución de ácido cítrico necesarias para neutralizar la solución de carbonato de sodio |
Solución A | 2 gotas |
|
Solución B | 2 gotas |
|
- Neutraliza la solución A y registra en la tabla la cantidad de gotas utilizadas.
- Neutraliza la solución B y registra en la tabla la cantidad de gotas utilizadas.
Pregunta a los alumnos:
- ¿Qué solución es la más concentrada? ¿Cómo lo saben?
Los alumnos deben descubrir que se necesitan más gotas de ácido cítrico para neutralizar la solución B. Por lo tanto, la solución B debe estar más concentrada que la solución A. - Los antiácidos son medicamentos que las personas toman cuando el ácido del estómago les causa molestias. Un anuncio dice que el medicamento proporciona alivio para la indigestión ácida y la “acidez” estomacal. ¿Qué tipo de producto químico crees que contiene el medicamento?
Las bases neutralizan los ácidos, por lo que el producto químico es probablemente una base.
7 Extensión Adicional
Paso 8
Coloca un comprimido de Alka-Seltzer® en la solución indicadora y pide a los alumnos que interpreten lo que los cambios de color dicen sobre el pH de la solución.
Explica que Alka-Seltzer® contiene ácidos en polvo y una base. Los ácidos son ácido cítrico, que sabe un poco agrio, y ácido acetilsalicílico, que es aspirina. La base es polvo para hornear, también conocido por su nombre químico, bicarbonato de sodio.
Diles a los alumnos que observarán un comprimido de Alka-Seltzer en una solución indicadora universal. A continuación, utilizarán lo que saben sobre el indicador universal y sus cambios de color para describir si la solución es ácida o básica a medida que las sustancias del comprimido reaccionan.
Pregunta para investigar
¿Cómo cambia el pH de la solución durante una reacción química entre los ingredientes de un comprimido de Alka-Seltzer colocado en agua?
Materiales para cada grupo
- Solución indicadora universal en un vaso
- Agua
- Comprimido de Alka-Seltzer
- Cilindro graduado
- Bolsa plástica pequeña, con cierre hermético
Procedimiento
- Añade 20 ml de solución indicadora universal a una bolsa de plástico pequeña con cierre.
- Sella la bolsa.
Nota: Para que los alumnos no manipulen el Alka-Seltzer, que es un medicamento, debes colocar un comprimido de Alka-Seltzer en la bolsa para cada grupo.

Procedimiento para el maestro
- Añade un comprimido de Alka-Seltzer a la bolsa de cada grupo abriendo la esquina de la bolsa lo suficiente como para que pase un comprimido.
- Elimina la mayor cantidad de aire posible y haz pasar el comprimido de Alka-Seltzer por la abertura pequeña.
- Sella la bolsa y entrégala a uno de los alumnos. Indica a este alumno que agite la bolsa y la haga pasar para que cada miembro del grupo tenga la oportunidad de tenerla en sus manos.
Resultados esperados
Tan pronto como se coloque el comprimido de Alka-Seltzer en la bolsa, el color de la solución indicadora cambiará a rojo. Aparecen burbujas en la solución y la bolsa se infla. La solución también se enfría. Con el tiempo, la solución pasará a ser naranja, luego amarilla para finalmente tornarse verde.
Paso 9
Analiza las observaciones de los alumnos.
A medida que los colores cambian y las bolsas se inflan, pregunta a los alumnos:
- ¿Qué les dicen los cambios de color sobre el pH de la solución al principio, en la mitad y al final de la reacción química?
Inicio: la solución es ácida.
Mitad: la solución se está volviendo menos ácida.
Fin: la solución está neutralizada.
Los alumnos deben concluir que los ingredientes ácidos y básicos del comprimido se neutralizan entre sí.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Descargas
Para los estudiantes
- Lección 6.9 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 6.9 Plan de lección PDF | DOCX | Google Doc
- Lección 6.9 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Recursos para el Capítulo 6
- Capítulo 6 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 6 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda