Cambio de estado—congelamiento
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- El congelamiento es el proceso que hace que una sustancia cambie de líquido a sólido.
- El congelamiento ocurre cuando las moléculas de un líquido se desaceleran lo suficiente como para que sus atracciones hagan que se organicen en posiciones fijas, como un sólido.
Resumen
Los alumnos mezclarán hielo y sal en una lata de metal para enfriarla mucho. A continuación, verán cómo se forma agua líquida y hielo en la parte exterior de la lata. Luego, verán una animación de moléculas de agua que se organizan en forma de hielo.
Objetivo
Los alumnos podrán explicar, a nivel molecular, por qué una temperatura lo suficientemente baja puede hacer que el vapor de agua del aire se condense para formar agua líquida y luego se congele para formar hielo.

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas.
Materiales para cada grupo
- Lata metálica de sopa, limpia y vacía
- Sal
- Hielo
- Cuchara de metal o varilla resistente
- Cuchara pequeña
- Toalla de papel
Materiales para el maestro
- Pinzas
- Cinta adhesiva
Acerca de esta lección
Si el nivel de humedad en el aula es demasiado bajo, no podrás realizar las actividades de la sección Explora de esta lección. Sin embargo, puedes enseñar la lección de todas maneras, mostrando a los alumnos el video “Hielo en Lata”. Puede ser útil mostrarles a los alumnos la diferencia en sus resultados:
Descarga todos los recursos de la Lección 2.4
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 2.4: Cambio de estado—congelamiento."
Instrucciones
1 Involúcrate
Paso 1
Muestra a los alumnos que el agua líquida se expande cuando se congela para convertirse en hielo sólido.
Preparación del maestro
- Coloca 50 mililitros de agua en un cilindro de plástico graduado de 100 ml y déjalo en el congelador durante toda la noche.
- Al día siguiente, llévalo a clase y muestra a los alumnos que el nivel de hielo es mayor que el nivel de agua que tenía al principio. Explica a los alumnos que, a medida que el agua se congela, se expande y ocupa más espacio que el agua líquida.
Muestra la película Bomba de hielo.
Este video es de la serie Chemistry Comes Alive! y se utiliza con el permiso de la División de Educación Química de la Sociedad Estadounidense de Química.
Pregunta a los alumnos:
- ¿Por qué creen que el agua congelada en el recipiente de metal hizo que este estalle?
Las moléculas de agua se separan cuando el agua se congela. Este movimiento hizo que el contenedor de metal estalle. - ¿Por qué es probable que se generen baches en las carreteras durante los inviernos fríos? Pista: piensen en lo que sucedió con el recipiente de metal.
Cuando el agua penetra por las pequeñas grietas en la carretera y se congela, se expande y rompe el asfalto. Cuando esto continúa sucediendo debajo de la superficie, eventualmente se forma un bache.
Pregunta a los alumnos:
- ¿Qué creen que sucede con las moléculas de agua cuando el agua líquida cambia a hielo sólido?
Los alumnos aprendieron que, cuando el vapor de agua se enfría, las atracciones entre las moléculas de agua hacen que se condensen y se conviertan en agua líquida. Los alumnos pueden decir que las moléculas de agua se desaceleran lo suficiente como para que sus atracciones las mantengan unidas en forma de hielo.
Nota: Es posible que los alumnos digan que las moléculas de agua se acercan las unas a las otras para formar hielo. El agua es inusual, porque sus moléculas se separan cuando se congelan. Las moléculas de casi todas las demás sustancias se acercan cuando se congelan. Esto se verá con más detalle en el Capítulo 3, Densidad.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 2.4 Hoja de actividades PDF | DOCX | Google Doc
- Lección 2.4 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Consulta la guía del maestro para encontrar las preguntas y respuestas.
3 Explora
Paso 2
Pide a los alumnos que enfríen una lata de metal de modo que se forme hielo sobre ella.
Pregunta para investigar
¿Cómo se puede hacer para que el vapor de agua en el aire se condense y luego se congele?
Materiales para cada grupo
- Lata metálica de sopa, limpia y vacía
- Sal
- Hielo
- Cuchara de metal o varilla resistente
- Cuchara pequeña
- Toalla de papel
Materiales para el maestro
- Pinzas
- Cinta adhesiva
Preparación del maestro
Utiliza pinzas para doblar los bordes filosos de la lata hacia abajo. Luego, cubre el borde con 2 a 3 capas de cinta para conductos a fin de evitar posibles lesiones.

Procedimiento
- Seca el exterior de una lata con una toalla de papel.
- Coloca 3 cucharaditas de sal en el fondo de la lata. Llena la lata con hielo hasta aproximadamente la mitad.
- Agrega otras 3 cucharaditas de sal.
- Agrega más hielo hasta que la lata esté casi llena y agrega otras 3 cucharaditas de sal.

- Sujeta la lata firmemente y mezcla el hielo y la sal con una cuchara de metal o una varilla resistente durante aproximadamente 1 minuto. Retira la cuchara y observa el exterior de la lata. No la toques todavía.
- Espera entre 3 y 5 minutos. Mira las animaciones mientras esperas.
Nota: Después de completar el Paso 5, puedes optar por que los alumnos coloquen un termómetro dentro de la lata. La temperatura de la mezcla de sal y hielo estará por debajo del punto de congelación normal del agua, que es 0 °C.
Resultados esperados
Aparecerá una fina capa de hielo en la parte exterior de la lata. Los alumnos también pueden ver que hay agua líquida en la parte superior de la lata, donde no está tan frío.
Obtén más información en Información contextual para el maestro sobre por qué la sal disminuye la temperatura en una mezcla de agua con hielo.
- Lección 2.4 Información contextual para el maestro PDF
Paso 3
Analiza las observaciones de los alumnos y pregunta cómo las atracciones y el movimiento de las moléculas pueden explicar los cambios de estado.
Pregunta a los alumnos:
- Observen y toquen la parte exterior de la lata. ¿Qué observan?
Una fina capa de hielo cubre la parte más fría de la lata. Algunas gotas pequeñas de agua pueden aparecer más arriba en la lata, donde no está tan frío. - Describan lo que sucede con las moléculas de agua a medida que pasan de ser vapor de agua cerca de la lata a hielo en la lata.
Las moléculas de vapor de agua en el aire cerca de la lata se enfrian cuando se transfiere energía desde el aire a la lata fría. Estas moléculas de agua se desaceleraron, se condensaron en agua líquida y luego se congelaron hasta convertirse en hielo. - Es posible que haya un poco de agua y de hielo en la parte exterior. Expliquen cómo puede ser posible.
Aparecen pequeñas gotas de agua en la parte de la lata por encima del hielo, porque las moléculas se desaceleran y condensan para convertirse en agua líquida. El hielo aparece en la parte más fría de la lata porque el vapor de agua que entró en contacto con esta parte de la lata se enfrió tanto que se congeló.
Da a los alumnos tiempo para responder preguntas sobre la actividad y las animaciones.
4 Explica
Paso 4
Muestra una animación del modelo molecular para ayudar a los alumnos a visualizar lo que sucede cuando se congela el agua.
Proyecta la animación Estructura del hielo.
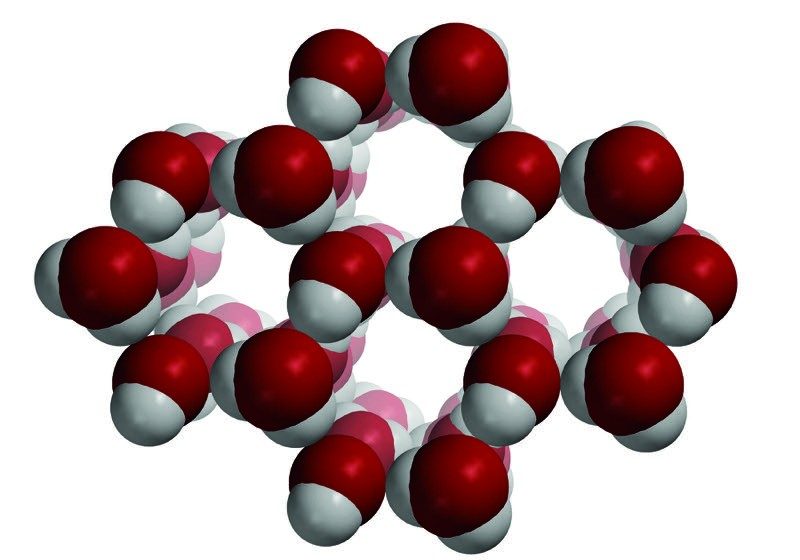
Señala que cuando el agua se congela, las moléculas de agua se han desacelerado lo suficiente como para que sus atracciones las ubiquen en posiciones fijas. Las moléculas de agua se congelan en un patrón hexagonal y las moléculas están más lejos de como estaban cuando eran agua líquida.
Nota: Las moléculas en el hielo estarían vibrando. Las vibraciones no se muestran aquí, pero se pueden ver en la siguiente animación.
Proyecta la animación Hielo en ángulo diferentes.
Explica que esta animación muestra diferentes vistas de un cristal de hielo. Señala que aunque el hielo esté frío, las moléculas todavía están en movimiento. Vibran, pero no se mueven en relación con las demás.
Paso 5
Haz que los alumnos comparen modelos moleculares de agua líquida y hielo.
Proyecta la imagen de Agua y Hielo.
Pregunta a los alumnos:
- ¿Cuáles son algunas de las diferencias entre el agua líquida y el hielo sólido?
Las moléculas en agua líquida están más cerca que en el hielo. En comparación con otras sustancias, el agua es inusual en este sentido. Las moléculas en el líquido se mueven en relación con las demás. El componente de hidrógeno de una molécula de agua se ve atraído por el componente de oxígeno de otra, pero solo por un corto tiempo, porque están en movimiento.
Las moléculas en el hielo están más separadas que en el agua líquida. Este es el motivo por el que hielo flota en el agua. Las moléculas en hielo se encuentran en posiciones fijas, pero siguen vibrando.
Paso 6
Haz que cada grupo organice sus moléculas de agua en un anillo de hielo de seis lados.
No es necesario que los alumnos orienten las moléculas exactamente igual a como están en el modelo de ocupación de espacio, pero deben intentar tener un átomo de hidrógeno de una molécula cerca de un átomo de oxígeno de otra. Pide a los alumnos que manejen sus modelos con cuidado porque los necesitarán para otras lecciones.
Paso 7
Habla sobre por qué los diferentes líquidos tienen diferentes puntos de congelación.
Diles a los alumnos que la temperatura a la que una sustancia se congela se denomina punto de congelación. El punto de congelación del agua es de 0 °C (32 °F). El aceite de maíz y el alcohol isopropílico tienen puntos de congelación más bajos que el agua. Esto significa que deben llevarse a temperaturas más bajas para que se congelen.
Agua | 0 °C |
Aceite de maíz | alrededor de–20 °C |
Alcohol isopropílico | –88.5 °C |
Pregunta a los alumnos:
- ¿Por qué creen que los diferentes líquidos tienen diferentes puntos de congelación?
Ayuda a los alumnos a darse cuenta de que cada líquido está compuesto por diferentes moléculas. Las moléculas de un líquido se atraen entre sí en diferente medida. Las moléculas tienen que desacelerarse en grados diferentes antes de que sus atracciones tengan efecto y las organicen en posiciones fijas, como un sólido.
Paso 8
Invita a los alumnos a considerar el punto de congelación de un gas.
Diles a los alumnos que el aire que los rodea está compuesto por diferentes tipos de gases. Las atracciones entre las moléculas de los gases en el aire (excepto el vapor de agua) son tan débiles que deben llevarse a temperaturas muy bajas para condensarse en un líquido o congelarse como un sólido.
El gas de nitrógeno constituye aproximadamente el 80 % del aire. Si el nitrógeno se enfría lo suficiente, las débiles atracciones entre sus moléculas pueden hacer que se condense en forma de líquido. El nitrógeno se condensa para formar un líquido a -196 °C.
Muestra el video Nitrógeno líquido.
Haz que los alumnos vean qué tan frío es el nitrógeno líquido mirando el siguiente video.
5 Extend
Paso 9
Muestra algunas imágenes de escarcha y presenta la idea de que las sustancias a veces pueden cambiar directamente de un gas a un sólido.
Diles a los alumnos que, en algunas condiciones, un gas puede convertirse directamente en un sólido sin pasar por la fase líquida. Explica que este proceso se denomina deposición. Parte del hielo que se formó en el exterior del metal puede haber sido el resultado de la deposición.
Obtén más información sobre cómo los cambios de estado se relacionan con el clima en Información contextual para el maestro.
- Lección 2.4 Información contextual para el maestro PDF
Proyecta la imagen Escarcha.
Diles a los alumnos que la escarcha que se deposita en el suelo, las ventanas o el césped en invierno se forma por deposición.
Da tiempo para que los alumnos respondan preguntas sobre puntos de congelación, nitrógeno y deposición, que les ayudarán a completar sus hojas de actividades para esta lección.
También puedes mostrarles a los alumnos imágenes de copos de nieve y el video de un copo de nieve en formación.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Descargas
Para los estudiantes
- Lección 2.4 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 2.4 Plan de lección PDF | DOCX | Google Doc
- Lección 2.4 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
- Lección 2.4 Información contextual para el maestro PDF
Recursos para el Capítulo 2
- Capítulo 2 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 2 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda