¿Pueden disolverse los líquidos en agua?
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- Los líquidos tienen propiedades características basadas en las moléculas de las que están hechos.
- Las propiedades de los líquidos dependen de las atracciones que las moléculas del líquido experimentan entre sí y con respecto a otras sustancias.
- Los líquidos pueden disolver algunos otros líquidos en función de las atracciones existentes entre las moléculas de ambos líquidos.
- Los líquidos polares, como el agua, disuelven otros líquidos que son polares o de alguna forma polares.
- Los líquidos polares, como el agua, no disuelven líquidos apolares, como el aceite.
Resumen
Los alumnos colocarán alcohol isopropílico, aceite mineral y jarabe de maíz en agua para ver si alguno de estos líquidos se disuelve en agua. Los alumnos ampliarán su comprensión y definición de “disolución” y verán que ciertos líquidos, pero no todos, pueden disolverse en agua.
Objetivo
Los alumnos identificarán y controlarán las variables para ayudar a diseñar una prueba de solubilidad para diferentes líquidos en agua. Los alumnos podrán explicar, a nivel molecular, por qué ciertos líquidos, pero no todos, se disuelven en agua. También podrán explicar que la solubilidad de un líquido es una propiedad característica de ese líquido.

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas. El alcohol isopropílico es inflamable. Mantenlo alejado de cualquier llama o fuente de chispa. Lee y sigue todas las advertencias de la etiqueta. El alcohol isopropílico y el aceite mineral deben desecharse de acuerdo con la normativa local. Pide a los alumnos que se laven las manos después de la actividad.
Materiales para las demostraciones
- Vaso de plástico transparente
- Agua
- Colorante de alimentos
- Sorbete o palito de helado
- Alcohol isopropílico (al 70 % o más)
- 2 cilindros graduados idénticos de 100 ml
Materiales para cada grupo
- Agua
- Aceite mineral
- Alcohol isopropílico (al 70 % o más)
- Jarabe de maíz
- 3 vasos de plástico transparente
- 5 vasos pequeños
- Marcador permanente o cinta de enmascarar y un bolígrafo para etiquetar los recipientes
- 3 sorbetes o palitos de helado (para revolver)
- Tarjeta de índice laminada o cubierta con papel encerado
- Agua azul
- Alcohol isopropílico amarillo (al 70 % o más)
- 2 goteros
- Palillo de dientes o palito de helado
Descarga todos los recursos de la Lección 5.7
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 5.7: ¿Pueden disolverse los líquidos en agua?"
Instrucciones
1 Involúcrate
Paso 1
Haz una demostración para presentar la idea de que los sólidos no son las únicas sustancias que pueden disolverse; los líquidos también pueden disolverse en líquidos.
Pide a los alumnos que hagan una predicción:
- Los sólidos, como la sal o el azúcar, se pueden disolver en agua. ¿Crees que los líquidos se pueden disolver en agua?
Pregunta para investigar
¿El colorante de alimentos se disuelve en agua?
Materiales para la demostración
- Vaso de plástico transparente
- Agua
- Colorante de alimentos
- Sorbete o palito de helado
Nota: En el capítulo 1, se realizó una demostración similar como prueba de que las moléculas están en movimiento. En esta ocasión, la demostración se utiliza para mostrar la atracción entre las moléculas de agua y las moléculas del colorante líquido que permiten que el color se disuelva en el agua.

Procedimiento
- Sostén un vaso de plástico transparente u otro recipiente transparente que contenga agua a temperatura ambiente. Añade 1 o 2 gotas de colorante de alimentos y deja que el color descienda y se extienda por el agua un poco.
- Revuelve con un sorbete o palito de helado.
Resultados esperados
El colorante de alimentos fluirá y se mezclará lentamente en el agua. Al revolverlo, el agua tomará un color uniforme.
Pregunta a los alumnos:
- ¿El colorante de alimentos se disuelve en agua?
Sí. - ¿Cómo sabes cuándo un soluto, como el colorante de alimentos, se ha disuelto en un disolvente, como el agua?
Como parte de la respuesta a esta pregunta, repasa la definición de disolución utilizando el ejemplo del colorante de alimentos y el agua. El soluto (colorante de alimentos) se disuelve en el disolvente (agua) cuando las moléculas del soluto se entremezclan exhaustivamente en el interior de las moléculas del disolvente que no se asientan ni se separan. - Esta demostración demostró que el colorante de alimentos puede disolverse en agua. Describe un experimento que podrías hacer para comparar cómo se disuelven en agua el alcohol isopropílico, el aceite mineral y el jarabe de maíz.
Los alumnos deben ponerse de acuerdo en que necesitarán tres vasos llenos con la misma cantidad de agua. También deben darse cuenta de que es importante utilizar la misma temperatura para el agua en cada vaso y que la temperatura de cada uno de los tres líquidos que se están probando también debe ser la misma.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 5.7 Hoja de actividades PDF | DOCX | Google Doc
- Lección 5.7 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos describirán el diseño de su experimento, registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Observa la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explora
Paso 2
Pide a los alumnos que realicen una actividad para ver cómo se disuelven en agua el alcohol isopropílico, el aceite mineral y el jarabe de maíz.
Pregunta para investigar
¿Se disuelven en agua el alcohol isopropílico, el aceite mineral y el jarabe de maíz?
Preparación del maestro para cada grupo
- Para cada grupo, coloca etiquetas en 3 vasos pequeños que digan “Alcohol”, “Aceite” y “Jarabe”.
- Vierte aproximadamente 1 cucharada de alcohol isopropílico, aceite mineral y jarabe de maíz en los vasos etiquetados.
Materiales para cada grupo
- Agua
- Alcohol isopropílico (al 70 % o más) en un vaso pequeño y etiquetado
- Aceite mineral en un vaso pequeño y etiquetado
- Jarabe de maíz en un vaso pequeño y etiquetado
- 3 vasos de plástico transparente
- Marcador permanente o cinta de enmascarar y un bolígrafo para etiquetar los recipientes
- 3 sorbetes o palitos de helado para revolver

Procedimiento
- Etiqueta 3 vasos de plástico transparente para que digan Alcohol, Aceite y Jarabe.
- Vierte agua en los tres vasos etiquetados hasta que cada uno esté lleno hasta aproximadamente la mitad.
- Mientras miras el agua desde un lado, vierte lentamente el alcohol en el recipiente etiquetado.
- Sin revolver, observa si el alcohol se disuelve en el agua por sí solo. Anota tus observaciones en la tabla proporcionada.
- Después de esperar unos 10 segundos, revuelve para ver si el alcohol se disuelve. Registra tus observaciones.
- Repite los pasos 2 a 5 para el aceite y el jarabe de maíz.
Resultados esperados
- El alcohol adopta un aspecto gris y espiralado a medida que se mezcla con el agua. El alcohol tiende a permanecer en la superficie del agua porque es menos denso que el agua. No parece disolverse inmediatamente, pero se disuelve cuando se lo revuelve.
- El aceite permanece en la superficie del agua porque es menos denso que el agua, pero no parece mezclarse mucho con el agua. Cuando se lo agita, el aceite se rompe un poco y luego forma una capa en la superficie del agua nuevamente. El aceite no se disuelve.
- El jarabe de maíz se hunde en el agua porque es más denso que el agua. Parece permanecer ahí sin disolverse mucho inicialmente. Después de revolverlo, el jarabe de maíz se disuelve en el agua y la solución se vuelve transparente.
Paso 3
Analiza las observaciones de los alumnos.
Pide a los alumnos que describan el aspecto del alcohol, el aceite y el jarabe de maíz en el agua y si se disolvieron o no.
Pregunta a los alumnos:
- ¿Puede un líquido disolver otro líquido?
Los alumnos deben darse cuenta de que algunos líquidos, pero no todos, pueden disolverse en agua. - Según tus observaciones sobre la forma en que el alcohol isopropílico, el aceite mineral y el jarabe de maíz se disuelven en agua, ¿dirías que la solubilidad es una propiedad característica de un líquido? ¿Por qué?
Sí. La solubilidad es una propiedad característica porque cada líquido interactúa con el agua de forma diferente.
4 Explica
Paso 4
Comenta cómo la estructura molecular del alcohol isopropílico, el aceite mineral y la glucosa (en el jarabe de maíz) determina si cada líquido se disolverá en agua o no.
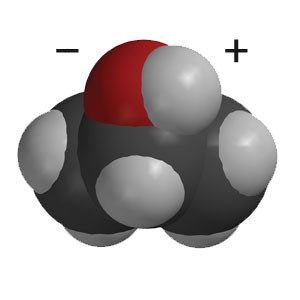
Proyecta la imagen Alcohol isopropílico.
Señala el enlace entre el oxígeno y el hidrógeno en un área de la molécula de alcohol.
Pregunta a los alumnos:
- ¿Qué saben ya sobre el enlace O–H?
Es polar. El oxígeno tiene una ligera carga negativa y el hidrógeno tiene una ligera carga positiva. - ¿Cómo creen que afecta esta parte polar de la molécula a la solubilidad del alcohol?
Aunque el alcohol tiene un área polar (enlaces O–H) y un área apolar más grande (enlaces C–H), las moléculas de agua polares y el área polar de las moléculas de alcohol se atraen entre sí, lo que hace que el alcohol se disuelva en agua.
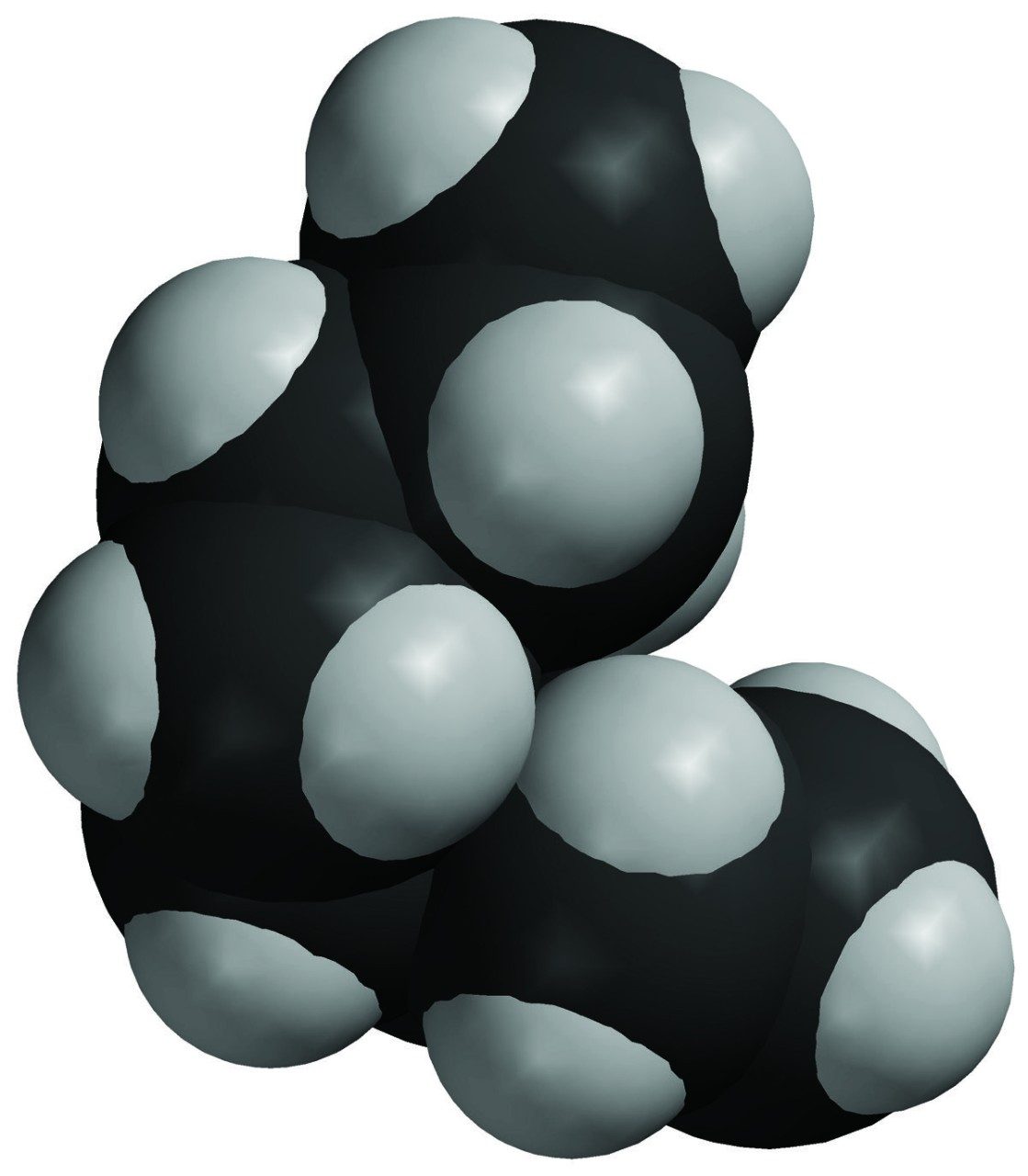
Proyecta la imagen Aceite mineral.
Recuerda a los alumnos que los átomos de carbono (gris más oscuro) e hidrógeno comparten los electrones de forma bastante uniforme. Esto significa que los enlaces en el aceite mineral son apolares, por lo que las moléculas de agua y las moléculas de aceite mineral no se atraen entre sí.
- ¿Por qué creen que el aceite no se disuelve en agua?
La molécula de aceite mineral está formada por átomos de carbono enlazados a átomos de hidrógeno. El enlace entre estos átomos crea muy poca polaridad. El agua no se ve muy atraída al aceite y, por lo tanto, no lo disuelve. - En algunos aderezos para ensalada, una capa de aceite, de canola o aceite de oliva, flota sobre una capa de vinagre, que es principalmente agua. Si se agita una botella de este tipo de aderezo de ensalada, los líquidos se combinarán temporalmente. Pero el aceite y el vinagre no se disuelven el uno en el otro porque finalmente los dos líquidos se separan de nuevo. Sabiendo lo que saben sobre las moléculas y la disolución, ¿por qué el aceite en estos aderezos de ensalada no se disuelve en el vinagre?
El aceite es apolar y no se ve atraído al agua en el vinagre, por lo que no se disolverá.
Nota: Los alumnos deben entender que las moléculas polares, como el agua, atraen a otras moléculas polares, pero no atraen a moléculas apolares, como el aceite. Al nivel de la escuela secundaria, esta comprensión es suficiente, pero podría dar la impresión de que las moléculas apolares no experimentan ninguna atracción. Esto no es cierto.
Lee más sobre las atracciones entre moléculas apolares en la sección de Información contextual para el maestro al final de esta lección.
- Lección 5.7 Información contextual para el maestro PDF
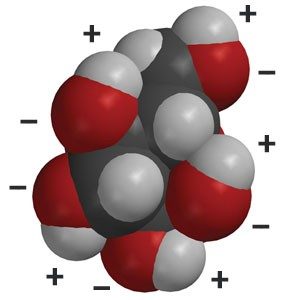
Proyecta la imagen Glucosa.
Explica a los alumnos que el jarabe de maíz es principalmente glucosa, pero que también contiene un azúcar similar, fructosa. Muéstrales a los alumnos la molécula de glucosa y señala los enlaces entre el oxígeno e hidrógeno.
Nota: Es posible que los alumnos hayan oído hablar del “jarabe de maíz de alta fructosa” utilizado en bebidas gaseosas y en algunos alimentos preparados. Este tipo de jarabe de maíz contiene un mayor porcentaje de fructosa que el jarabe de maíz que se vende habitualmente en la góndola de cocina de los supermercados.
Pregunta a los alumnos:
- ¿Por qué creen que las moléculas de glucosa se disuelven bien en agua?
La glucosa tiene muchas áreas en las que el oxígeno se enlaza al hidrógeno. Estos enlaces O–H son polares. Las moléculas polares de agua y las áreas polares de las moléculas de glucosa se atraen entre sí, lo que provoca que el jarabe de maíz se disuelva. - A algunas personas con diabetes les puede ocurrir que su nivel de azúcar baje demasiado. Existen comprimidos de glucosa para ayudarles a resolver este problema. Cuando una persona ingiere uno, ¿creen que actuará rápidamente para aumentar su nivel de azúcar en sangre? ¿Por qué sí o por qué no?
Sí. El comprimido actuará rápidamente porque el agua presente en la saliva y el estómago de una persona disolverá con facilidad la glucosa.
5 Amplía
Paso 5
Observa más de cerca la forma en que se mezclan el agua y el alcohol.
El agua y el alcohol experimentan cosas muy interesantes cuando se los mezcla. Diles a los alumnos que has pintado el agua de color azul y el alcohol isopropílico de amarillo para que puedan ver mejor la mezcla.
Materiales para cada grupo
- Agua (color azul)
- Alcohol isopropílico (al 70 % o más, coloreado de amarillo)
- Tarjeta de índice laminada o cubierta con papel encerado
- 2 goteros
- Palillo de dientes o palito de helado

Procedimiento
- Usa un gotero para colocar unas 5 gotas de agua azul juntas y crear 1 gota grande sobre tu tarjeta de índice.
- Utiliza otro gotero para crear una gota grande similar de alcohol amarillo cerca de la gota azul, pero sin tocarla.
- Utiliza un palillo de dientes para arrastrar el agua azul hacia el alcohol amarillo hasta que se toquen. Tan pronto como las gotas se toquen, retira el palillo de dientes y no revuelvas.
- Observa más de cerca a medida que se mezclan el agua y el alcohol.
Resultados esperados
El alcohol y el agua “temblarán” o se “sacudirán” de cierta forma en el lugar exacto en el que se mezclan.
Paso 6
Analiza las observaciones de los alumnos.
Pregunta a los alumnos:
- ¿Qué observan cuando se combinan la gota de alcohol y la gota de agua?
Los alumnos notarán que el alcohol y el agua parecen temblar en la zona en la que se mezclan. A medida que se mezclan los líquidos, los colores amarillo y azul se combinan para crear el color verde.
Diles a los alumnos que la mezcla de alcohol y agua no se comprende por completo a nivel molecular. Una de las razones del aspecto tembloroso podría ser que el alcohol es menos denso que el agua, por lo que, al mezclarse con el agua, la densidad del líquido en general cambia. El alcohol (que por sí solo flota en el agua) se hunde mientras se mezcla. Quizás muchos pequeños “hundimientos” hacen que la mezcla se vea temblorosa. Podría ser que el cambio en la densidad haga que la luz se refracte de forma diferente para provocar ese aspecto tembloroso. Tal vez el alcohol interfiera con la tensión superficial del agua, y esto hace que la superficie parezca temblar. También es cierto que, cuando se mezclan agua y alcohol, la solución se vuelve más tibia. Tal vez el calor aumente el movimiento molecular en la superficie, lo que contribuye de alguna manera al aspecto tembloroso.
Paso 7
Haz una demostración para demostrar que cuando se combinan agua y alcohol, el volumen de la solución resultante es menor de lo esperado.
Diles a los alumnos que la forma característica en que el agua y el alcohol interactúan entre sí causa otro fenómeno interesante.
Materiales para la demostración
- Alcohol isopropílico (al 90 % o más)
- Agua
- 2 cilindros graduados idénticos de 100 ml

Procedimiento
- Mide 50 ml de alcohol isopropílico y vuélcalos en un cilindro graduado 100 ml.
- Mide 50 ml de agua y añádelos al alcohol en el cilindro graduado de 100 ml.
Resultados esperados
El volumen total del líquido será de aproximadamente 97 ml o 98 ml. Esto es sorprendente porque 50 ml de agua + 50 ml de agua equivalen a 100 ml.
Explícales a los alumnos que cuando las moléculas de agua y alcohol interactúan, se reorganizan y ocupan menos espacio que si se sumaran sus volúmenes individuales.
Nota: Es posible que hayas oído la explicación de que las moléculas de agua se ubican en los espacios entre las moléculas de alcohol, o que las moléculas de alcohol se ubican en los espacios entre las moléculas de agua. Es una explicación demasiado pasiva. No es como si cayeran canicas en los espacios entre pelotas de golf. Hay una reorganización activa de las moléculas que se atraen entre sí, que da lugar al volumen final. De hecho, añadir dos líquidos cualesquiera que se puedan disolver el uno en el otro dará lugar a un volumen diferente de la suma de los volúmenes de líquido por separado. El alcohol y el agua se utilizan a menudo para ejemplificar este fenómeno porque son fáciles de conseguir y muestran una diferencia particularmente grande.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Simulaciones
Vea todas las imágenes de la Lección 5.7 en la página de simulaciónes.
Descargas
Para los estudiantes
- Lección 5.7 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 5.7 Plan de lección PDF | DOCX | Google Doc
- Lección 5.7 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
- Lección 5.7 Información contextual para el maestro PDF
Recursos para el Capítulo 5
- Capítulo 5 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 5 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda