El agua es una molécula polar
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
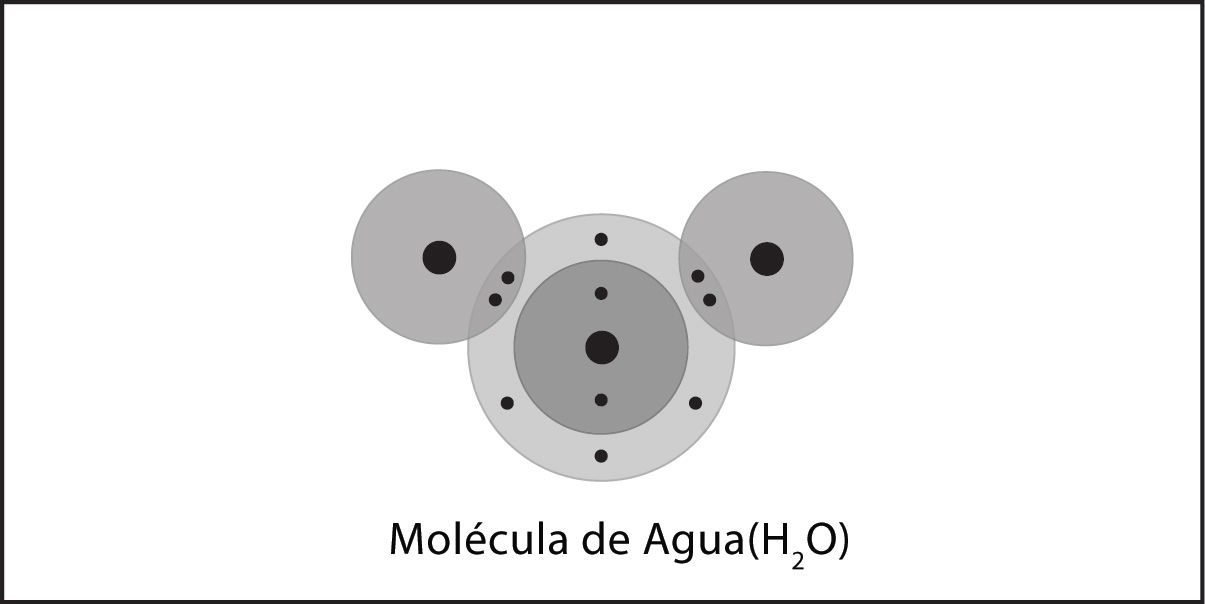
- La molécula de agua, en su conjunto, tiene 10 protones y 10 electrones, por lo que es neutra.
- En una molécula de agua, el átomo de oxígeno y los átomos de hidrógeno comparten electrones en enlaces covalentes, pero el intercambio no es igual.
- En el enlace covalente entre el oxígeno y el hidrógeno, el átomo de oxígeno atrae a los electrones un poco más fuertemente que los átomos de hidrógeno.
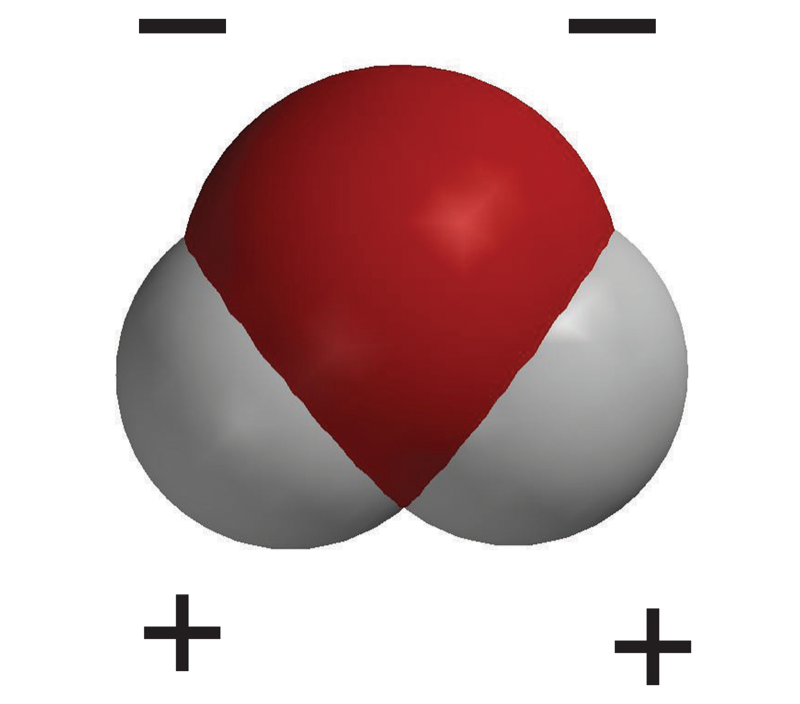
- El intercambio desigual de electrones proporciona a la molécula de agua una ligera carga negativa cerca de su átomo de oxígeno y una ligera carga positiva cerca de sus átomos de hidrógeno.
- Cuando una molécula neutra tiene un área positiva en un extremo y un área negativa en el otro, es una molécula polar.
- Las moléculas de agua se atraen entre sí en función de la atracción entre el extremo positivo de una molécula de agua y el extremo negativo de otra.
Resumen
Se presentará a los alumnos la idea de que el agua tiene una carga ligeramente positiva en un extremo de la molécula y una carga ligeramente negativa en el otro (una molécula polar). Los alumnos ven animaciones, hacen ilustraciones y utilizan sus propios modelos de moléculas de agua para comprender cómo la naturaleza polar de las moléculas de agua puede ayudar a explicar algunas características importantes del agua.
Objetivo
Los alumnos podrán explicar, a nivel molecular, lo que hace que el agua sea una molécula polar. Los alumnos también podrán mostrar en un dibujo que la naturaleza polar del agua puede explicar algunas de las características interesantes del agua y ayudar a explicar su tasa de evaporación en comparación con un líquido menos polar.

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas. El alcohol isopropílico es inflamable. Mantenlo alejado de cualquier llama o fuente de chispa. Lee y sigue todas las advertencias de la etiqueta. Usa el producto en una sala bien ventilada. Desecha pequeñas cantidades por el desagüe o de acuerdo con la normativa local. Pide a los alumnos que se laven las manos después de la actividad.
Materiales para cada grupo
- Modelos de moléculas de agua de espuma de poliestireno del Capítulo 2, Lección 2 (dos por alumno)
- Marcadores permanentes (azul y rojo)
- Alcohol isopropílico (al 70 % o más)
- Agua
- Toalla de papel marrón
- Goteros
Nota sobre los materiales
Los alumnos crearon modelos moleculares de la molécula de agua utilizando esferas de espuma de poliestireno y palillos de dientes en el Capítulo 2, Lección 2. Entrega a cada alumno dos de estos modelos de moléculas de agua para esta actividad.
Descarga todos los recursos de la Lección 5.1
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 5.1: El agua es una molécula polar."
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Instrucciones
1 Involúcrate
Paso 1
Muestra a los alumnos ejemplos de atracción de las moléculas de agua entre sí.
Recuerda a los alumnos que, en los Capítulos 1 y 2, investigaron el comportamiento del agua a diferentes temperaturas y se exploraron los cambios de estado del agua. Muchas de las explicaciones se basaron en la idea de que las moléculas de agua se atraen entre sí. Recuerda a los alumnos que, en el Capítulo 4, analizaron la unión covalente entre oxígeno e hidrógeno, que crea la molécula de agua. Ahora, los alumnos examinarán más de cerca los detalles de los enlaces covalentes en una molécula de agua para comprender por qué las moléculas de agua se atraen entre sí.
Proyecta el video Globo de agua.
Este video se muestra en el Capítulo 1, Lección 1, para mostrar que las moléculas de agua se atraen entre sí.
Proyecta el video Fuente de agua.
Señala que el agua es capaz de permanecer junta en estos arcos porque las moléculas de agua se atraen mucho entre sí.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 5.1 Hoja de actividades PDF | DOCX | Google Doc
- Lección 5.1 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán junto con la clase, en grupos o individualmente, según tus instrucciones. Observa la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explica
Paso 2
Muestra las animaciones del modelo molecular que ilustran por qué las moléculas de agua se atraen entre sí.
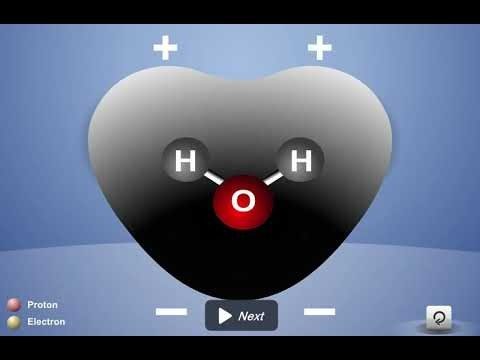
Proyecta la animación Molécula de agua polar.
Primer fotograma de la animación:
- Los electrones se comparten entre dos átomos en un enlace covalente.
Recuerda a los alumnos cómo los electrones compartidos de una molécula de agua se ven atraídos a los protones tanto de los átomos de oxígeno como de hidrógeno. Estas atracciones mantienen unidos los átomos. - Las moléculas de agua son neutras.
Asegúrate de que los alumnos se den cuenta de que no se ganan ni se pierden protones ni electrones. La molécula de agua tiene un total de 10 protones y 10 electrones (8 del átomo de oxígeno y 1 de cada uno de los dos átomos de hidrógeno). Dado que tiene la misma cantidad de protones que de electrones, la molécula de agua es neutra.
Haz clic en “Reproducir”
- El modelo de nube de electrones muestra dónde se encuentran los electrones en una molécula.
Diles a los alumnos que otra forma de ver la diferencia en el lugar en el que se encuentran los electrones es mediante el uso del modelo de nube de electrones. Recuerda a los alumnos que es imposible conocer la ubicación exacta de un electrón, por lo que a veces las regiones ocupadas por los electrones se muestran como “nubes” alrededor del núcleo en un átomo o molécula. - El intercambio desigual de electrones hace que el agua sea una molécula polar.
Diles a los alumnos que el átomo de oxígeno atrae a los electrones un poco más fuertemente que el hidrógeno. Por lo tanto, aunque los electrones de cada átomo se atraen tanto por el oxígeno como por el hidrógeno, los electrones se ven un poco más atraídos al oxígeno. Esto significa que los electrones pasan un poco más de tiempo del lado del oxígeno de la molécula. Esto hace que el lado del oxígeno de la molécula sea ligeramente negativo. Dado que los electrones no están tan cerca del lado del hidrógeno, ese lado es ligeramente positivo. Cuando una molécula con unión covalente tiene más electrones en un área que en otra, se denomina molécula polar. - El modelo de nube de electrones puede mostrar un intercambio desigual de electrones.
Señala que la nube de electrones alrededor del oxígeno es más oscura que la nube de electrones alrededor del hidrógeno. Esto muestra que los electrones se ven más atraídos al lado del oxígeno de la molécula que al lado del hidrógeno, lo que hace que la molécula de agua sea polar.
Haz clic en “Siguiente”
- Se puede añadir color a un modelo de nube de electrones para mostrar dónde hay más o menos probabilidades de que haya electrones.
Diles a los alumnos que este es otro modelo de una molécula de agua. En este modelo, se utiliza el color para mostrar las áreas polares de la molécula de agua. El área negativa cerca del átomo de oxígeno es roja y el área positiva cerca de los átomos de hidrógeno es azul.
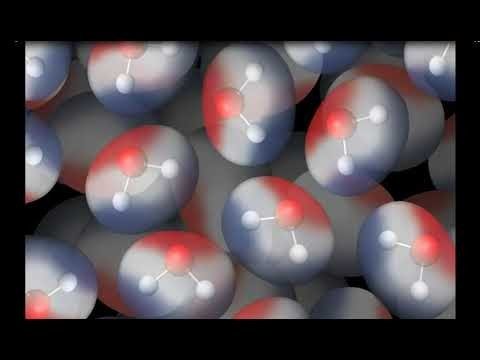
Proyecta la animación Atracción entre moléculas de agua.
Pregunta a los alumnos:
- ¿Qué notan sobre la forma en que están orientadas las moléculas de agua?
El área roja (oxígeno) de una molécula de agua está cerca del extremo azul (hidrógeno) de otra molécula de agua. - ¿Por qué las moléculas de agua se atraen unas a otras como esta?
Dado que el extremo del oxígeno de una molécula de agua es ligeramente negativo y el extremo del hidrógeno es ligeramente positivo, tiene sentido que las moléculas de agua se atraigan entre sí.
Entrega a cada alumno una hoja de actividades.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Observa la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
Paso 3
Muestra a los alumnos que los enlaces entre los átomos de una molécula son diferentes de las atracciones polares entre moléculas.
Proyecta la imagen Atracciones en diferentes niveles.
Los alumnos pueden sentirse confundidos por los enlaces dentro de una molécula de agua y las atracciones entre moléculas de agua.
Enlaces dentro de las moléculas y atracciones polares entre moléculas
Explica a los alumnos que la interacción entre el oxígeno de una molécula de agua y el hidrógeno de otra es diferente a los electrones que se comparten entre los átomos de oxígeno e hidrógeno dentro de la propia molécula de agua.
Todo se trata de atracciones entre positivo y negativo.
Señala a los alumnos que las atracciones entre positivo y negativo funcionan en tres niveles diferentes.
1. Un único átomo permanece unido debido a la atracción entre los protones con carga positiva y los electrones con carga negativa.

2. En una molécula, dos o más átomos permanecen unidos debido a la atracción mutua entre los protones con carga positiva de un átomo y los electrones con carga negativa del otro átomo. Esto provoca la unión covalente o iónica que mantiene unidos los átomos o iones.

3. Dos o más moléculas de agua permanecen unidas debido a las partes positiva y negativa de las moléculas que se atraen entre sí.

Paso 4
Haz que los alumnos marquen las áreas positivas y negativas de una molécula de agua codificando sus modelos de esferas de espuma de poliestireno.
Materiales para cada grupo
- Modelos de moléculas de agua de espuma de poliestireno del Capítulo 2, Lección 2 (dos por alumno)
- Marcadores permanentes (azul y rojo)
Procedimiento
- Dibuja un signo “+” azul en cada uno de los átomos de hidrógeno.
- Dibuja dos signos “–” rojos en la parte inferior del átomo de oxígeno.
- Repite esto en tu otra molécula de agua.
- Coloca las moléculas de agua de modo que las cargas opuestas estén cerca entre sí.
Pregunta a los alumnos:
- ¿Cómo se relacionan sus modelos de moléculas de agua de esferas de espuma de poliestireno con el modelo de densidad de carga codificado por colores que se muestra en la animación?
Los distintos colores muestran que el agua es una molécula polar. - ¿Qué representan los signos rojos “–” en el átomo de oxígeno?
Los signos rojos “–” representan la zona en la que hay más electrones. - ¿Qué representan los signos “+” azules de los átomos de hidrógeno?
Los signos “+” azules representan la zona en la que hay menos electrones. - Dado que las moléculas de agua son polares, ¿cómo se organizan en el agua líquida?
El área positiva de una molécula de agua se ve atraída hacia el área negativa de otra molécula de agua.
4 Explora
Paso 5
Solicita a los alumnos que diseñen una prueba para comparar la tasa de evaporación entre el agua y el alcohol.
Recuerda a los alumnos que las moléculas de agua son muy polares. Las fuertes atracciones entre moléculas de agua afectan la tensión superficial del agua, el punto de ebullición y la tasa de evaporación. Diles a los alumnos que harán un experimento para comparar las tasas de evaporación del agua y otro líquido que no es tan polar.
Pregunta a los alumnos:
- ¿Creen que una sustancia como el agua, con moléculas polares, se evaporaría más rápido o más lento que una sustancia como el alcohol, que tiene moléculas que no son tan polares?
Las moléculas más polares se unirán más y probablemente se evaporarán más lentamente que las moléculas menos polares. Las moléculas menos polares deben evaporarse más rápido porque no se atraen tanto entre sí. - ¿Cómo podrían diseñar una prueba de evaporación rápida y sencilla para comparar la tasa de evaporación entre el agua y el alcohol?
- ¿Qué materiales necesitarán?
- ¿Se debe usar la misma cantidad de agua y de alcohol?
- ¿Cómo sabrás si una se evapora más rápido que la otra?
- ¿Hay alguna forma de hacerlo que no te lleve mucho tiempo?
Paso 6
Haz que los alumnos realicen el procedimiento siguiente para comparar la tasa de evaporación entre el agua y el alcohol.

Pregunta para investigar
¿El agua se evapora más rápido o más lento que el alcohol, que es menos polar?
Materiales para cada grupo
- Alcohol isopropílico (al 70 % o más)
- Agua
- Toalla de papel marrón
- Goteros
Procedimiento
1. Al mismo tiempo, coloca 1 gota de agua y 1 gota de alcohol sobre una toalla de papel marrón. Observa.
Resultados esperados
La mancha oscura de la toalla de papel hecha por el alcohol se volverá más clara más rápido que la mancha oscura hecha por el agua. Esto indica que el alcohol se evapora más rápidamente que el agua.
Nota: Esta prueba es adecuada para los alumnos de secundaria, pero hay algo en la prueba que no la hace completamente razonable. Hay muchas más moléculas de agua en una gota de agua que moléculas de alcohol en una gota de alcohol. La prueba sería más razonable si se colocara la misma cantidad de moléculas de agua y alcohol en la toalla de papel. Esto requiere una forma para “contar” moléculas. Determinar la cantidad de partículas en una muestra es un concepto químico básico, pero está más allá del alcance de una unidad química de enseñanza media. Incluso si se utilizara la misma cantidad de moléculas de agua y alcohol en esta actividad, el alcohol se evaporaría más rápido.
5 Explica
Paso 7
Comenta las observaciones de los alumnos y describe las diferencias en la polaridad entre las moléculas de agua y alcohol.
Pregunta a los alumnos:
- ¿Qué se evaporó más rápido, el agua o el alcohol?
El alcohol se evaporaba más rápido.
Diles a los alumnos que comprender la polaridad puede ayudar a explicar por qué el agua se evapora más lentamente que el alcohol.
Proyecta la imagen Moléculas de agua y alcohol.
Recuerda a los alumnos que los enlaces de oxígeno-hidrógeno (O–H) en el agua hacen que sea una molécula polar. Esta polaridad hace que las moléculas de agua se atraigan entre sí.
Explica que el enlace de oxígeno-hidrógeno (O-H) en la molécula de alcohol también es polar. Sin embargo, los enlaces de carbono-hidrógeno (C–H) en el resto de la molécula de alcohol son apolares. En estos enlaces, los electrones se comparten de manera más o menos uniforme.
Debido a que hay áreas tanto polares como apolares en la molécula de alcohol, estas se atraen menos entre sí que las moléculas de agua. Esto facilita que las moléculas de alcohol se separen y se dispersen al aire como un gas. Por eso el alcohol se evapora más rápido que el agua.
6 Amplía
Paso 8
Pide a los alumnos que consideren cómo podría afectar la polaridad la temperatura a la que hierven el agua y el alcohol.
Sabes que el agua y el alcohol tienen características diferentes debido a las moléculas de las que están hechas y cómo estas moléculas interactúan entre sí.
Proyecta la imagen Ebullición del agua y el alcohol.
Esta ilustración muestra que el alcohol hierve a una temperatura menor que el agua.
- El agua hierve a 100 °C.
- El alcohol hierve a 82.5 °C.
Pregunta a los alumnos:
Sabiendo lo que sabes sobre la polaridad del agua y el alcohol, explica por qué el alcohol hierve a una temperatura menor que el agua.
La característica polar de las moléculas de agua hace que se atraigan entre sí. Las moléculas de alcohol menos polares no se atraen entre sí tan fuertemente como las moléculas de agua. Hace falta más energía para hacer hervir el agua que para hacer hervir el alcohol. En otras palabras, el alcohol hierve a una temperatura más baja que el agua.
Descargas
Para los estudiantes
- Lección 5.1 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 5.1 Plan de lección PDF | DOCX | Google Doc
- Lección 5.1 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
- Lección 5.1 Información contextual para el maestro PDF
Recursos para el Capítulo 5
- Capítulo 5 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 5 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda