Niveles de energía, electrones y enlaces covalentes
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- Los electrones del nivel de energía más externo del átomo se denominan electrones de valencia.
- Los electrones de valencia participan en el enlace de un átomo con otro.
- La atracción que siente el núcleo de cada átomo hacia los electrones de valencia del otro átomo mantiene juntos a los átomos.
- A medida que las atracciones unen a los átomos, los electrones de cada átomo se sienten atraídos al núcleo de ambos átomos, que “comparten” los electrones.
- El intercambio de electrones entre los átomos se denomina enlace covalente, que mantiene a los átomos unidos como una molécula.
- Un enlace covalente tiene lugar si las atracciones son lo suficientemente fuertes en ambos átomos y si cada átomo tiene espacio para alojar un electrón en su nivel externo de energía.
- Los átomos se enlazarán de manera covalente hasta que su nivel externo de energía se complete.
- Los átomos enlazados covalentemente como molécula son más estables que los átomos separados.
Resumen
Los alumnos verán las animaciones y consultarán los modelos de niveles de energía que han estado utilizando, para hacer dibujos del proceso de enlace covalente. Los alumnos considerarán por qué los átomos se unen para formar moléculas como H2 (hidrógeno), H2O (agua), O2 (oxígeno), CH4 (metano) y CO2 (dióxido de carbono).
Objetivo
Los alumnos serán capaces de explicar que la atracción entre los protones y los electrones de dos átomos hace que estos se unan. Los alumnos podrán dibujar un modelo de enlaces covalentes entre los átomos para el H2 (hidrógeno), H2O (agua), O2 (oxígeno), CH4 (metano) y CO2 (dióxido de carbono).

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas.
Acerca de esta lección
Esta lección probablemente lleve más de un período de clase.
Materiales para cada grupo
- Batería de 9 voltios
- 2 cables con pinzas cocodrilo en ambos extremos
- 2 lápices con punta en ambos extremos
- Agua
- Vaso de plástico transparente
- Sal de Epsom (sulfato de magnesio)
- Cinta
Descarga todos los recursos de la Lección 4.4
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 4.4: Niveles de energía, electrones y enlaces covalentes."
Instrucciones
1 Involúcrate
Paso 1
Muestra una animación para presentar el proceso de enlace covalente.
Introduce la pregunta que los alumnos investigarán en esta lección:
- Si los átomos tienen la misma cantidad de protones y electrones, ¿por qué los átomos se unen a otros átomos? ¿Por qué no se mantienen separados?
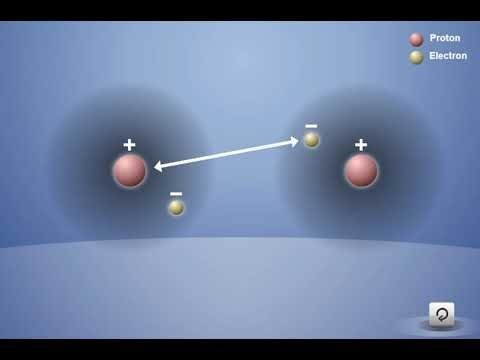
Comienza a responder esta pregunta usando el hidrógeno como ejemplo.
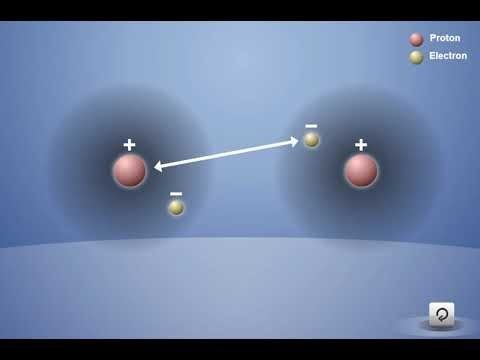
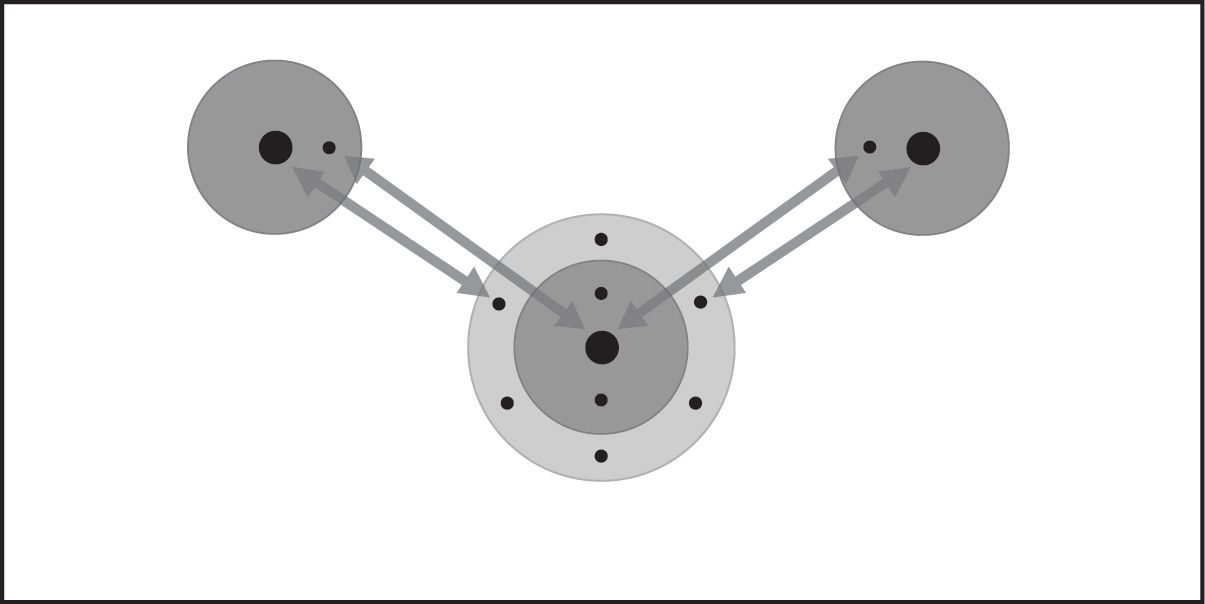
Proyecta la animación Enlace covalente en el hidrógeno.
Asegúrate de que los alumnos observen que cada átomo de hidrógeno tiene 1 protón y 1 electrón. Recuerda a los alumnos que el electrón y su propio protón se atraen entre sí. Explica que, si los átomos se acercan lo suficiente entre sí, el electrón de cada átomo de hidrógeno siente la atracción del protón del otro átomo de hidrógeno (como lo muestra la flecha de doble punta).
Obtén más información sobre los enlaces en Información contextual para el maestro.
- Lección 4.4 Información contextual para el maestro PDF
Destaca que las atracciones no son lo suficientemente fuertes como para alejar completamente al electrón de su propio protón. Sin embargo, las atracciones son lo suficientemente fuertes como para que los dos átomos se acerquen bastante y los electrones sientan la atracción de ambos protones para ser compartidos por ambos átomos.
Al final de la animación, explica que los átomos de hidrógeno individuales se han unido para convertirse en la molécula H2. Este tipo de enlace se denomina enlace covalente. En un enlace covalente, los electrones de cada átomo son atraídos o “compartidos” por ambos átomos.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 4.4 Hoja de actividades PDF | DOCX | Google Doc
- Lección 4.4 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán junto con la clase, en grupos o individualmente, según tus instrucciones. Observa la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explica
Paso 2
Analiza las condiciones necesarias para la unión covalente y la molécula estable que se forma.
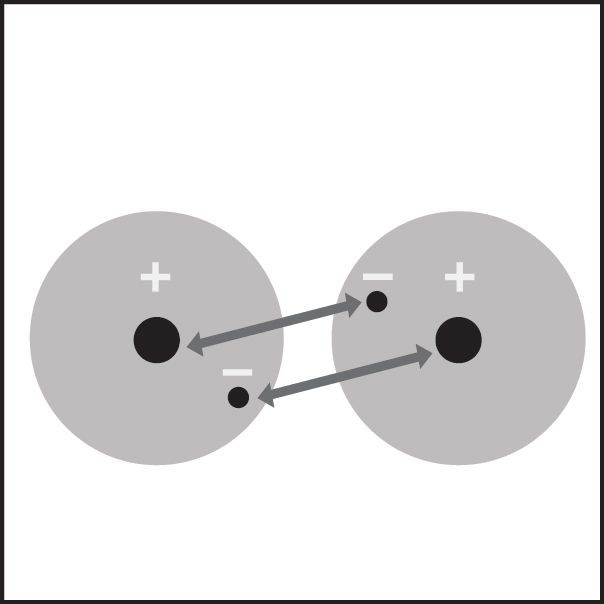
Proyecta la imagen Enlace covalente en el hidrógeno.
Nota: Este modelo de enlace covalente para la molécula de hidrógeno (H2) comienza con 2 átomos de hidrógeno individuales. En realidad, los átomos de hidrógeno no están separados. Siempre están enlazados con algo más. Para simplificar el proceso, este modelo no muestra cómo los átomos de hidrógeno rompen sus enlaces de otros átomos. Solo se centra en el proceso de formación de enlaces covalentes entre dos átomos de hidrógeno.
Dile a los alumnos que hay dos razones principales por las que dos átomos de hidrógeno pueden unirse para formar una molécula de hidrógeno:
- Debe existir una atracción lo suficientemente fuerte entre los electrones de cada átomo y los protones del otro átomo.
- Debe haber espacio en el nivel externo de energía de ambos átomos.
Una vez enlazada, la molécula de hidrógeno es más estable que los átomos de hidrógeno individuales. Explica a los alumnos que, al ser parte de un enlace covalente, el electrón de cada átomo de hidrógeno se aproxima a dos protones en lugar de al único protón con el que comenzó. Dado que los electrones están más cerca de más protones, la molécula de dos átomos de hidrógeno enlazados es más estable que los dos átomos de hidrógeno no enlazados individuales.
Por este motivo, es muy poco frecuente encontrar un átomo de hidrógeno que no esté enlazado a otros átomos. Los átomos de hidrógeno se unen con otros átomos de hidrógeno para producir gas hidrógeno (H2). O pueden unirse con otros átomos como el oxígeno para producir agua (H2O) o carbono para producir metano (CH4) o muchos otros átomos.
Paso 3
Muestra a los alumnos que cuando dos átomos de hidrógeno se unen, el nivel externo de energía se completa.
Pide a los alumnos que observen su Tabla periódica de niveles de energía para los elementos 1 al 20 distribuidos en la lección 3.
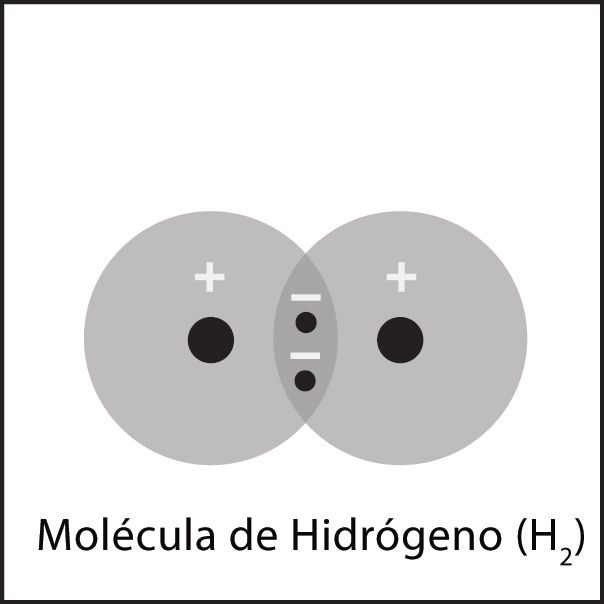
Explica que los dos electrones de la molécula de hidrógeno (H2) pueden considerarse como que “pertenecen” a cada átomo. Esto significa que cada átomo de hidrógeno tiene ahora dos electrones en su primer nivel de energía. El primer nivel de energía en el nivel externo de energía para el hidrógeno solo puede alojar o “retener” dos electrones. Los átomos se enlazarán de manera covalente hasta que sus niveles externos de energía estén completos. En este punto, los átomos adicionales no se unirán covalentemente a los átomos en la molécula H2.
Paso 4
Haz que los alumnos describan el enlace covalente de una molécula de hidrógeno en su hoja de actividades y revisa sus respuestas.
Entrega a cada alumno una hoja de actividades.
Haz que los estudiantes escriban una leyenda breve debajo de cada imagen para describir el proceso de enlace covalente y que respondan las primeras tres preguntas. El resto de la hoja de actividades se deberá completar en conjunto con la clase, en grupos o individualmente, según tus instrucciones.
Pregunta a los alumnos:
- ¿Qué escribieron para la segunda y tercera imagen del enlace covalente?
Dibujo central: Cuando dos átomos de hidrógeno se acercan lo suficiente, sus electrones se sienten atraídos al protón del otro átomo.
Último dibujo: esto acerca los átomos lo suficiente como para que compartan electrones. - ¿Cuáles son las dos condiciones que los átomos deben cumplir para formar enlaces covalentes entre sí?
Hay una atracción lo suficientemente fuerte entre los átomos y hay lugar para los electrones en el nivel externo de energía. - ¿Por qué una molécula de hidrógeno (H2) es más estable que dos átomos de hidrógeno individuales?
En la molécula de hidrógeno, los electrones de cada átomo pueden estar cerca de dos protones en lugar del único protón con el que comenzaron. Cuando los electrones negativos están cerca de más protones positivos, la disposición es más estable. - ¿Por qué un tercer átomo de hidrógeno no se une a la molécula H2 para formar H3?
Cuando dos átomos de hidrógeno comparten sus electrones entre sí, sus niveles externos de energía se completan.
Podrías explicar a los alumnos que cuando los niveles externos de energía están completos, compartir electrones con otro átomo no sucedería por dos motivos principales:
- Un electrón de un nuevo átomo tendría que unirse a un átomo de la molécula H2 en el siguiente nivel de energía, más allá del núcleo, donde no sentiría una atracción lo suficientemente fuerte.
- Un electrón de un átomo que ya se encuentra en la molécula H2 y cerca del núcleo debería alejarse más para compartir con el nuevo átomo.
Ambas posibilidades harían que la molécula sea menos estable y, por lo tanto, esto no ocurriría.
Paso 5
Analizar el proceso del enlace covalente en una molécula de agua.
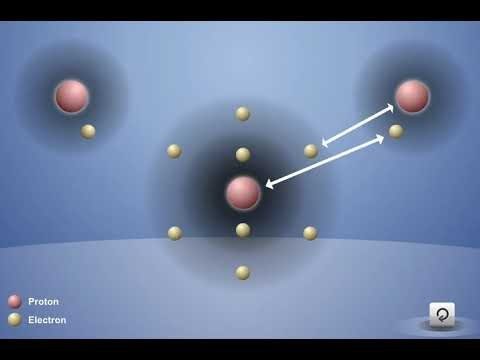
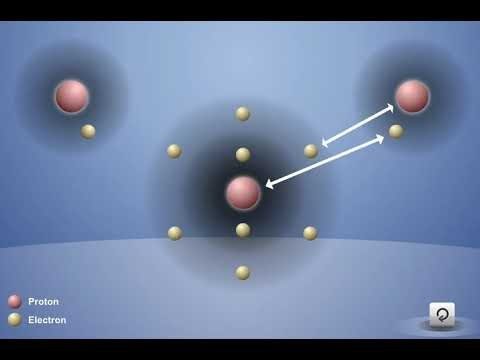
Proyecta la animación Enlace covalente en agua.
Antes de presionar el botón “reproducir”, señala el átomo de oxígeno y los dos átomos de hidrógeno. Pregunta a los alumnos:
- ¿Hay algo que podría atraer a estos átomos entre sí?
Los alumnos deben sugerir que los electrones de cada átomo son atraídos a los protones de los otros átomos.
Toca la animación para mostrar la atracción entre los protones de oxígeno con respecto al electrón de cada uno de los átomos de hidrógeno, la atracción del protón de los átomos de hidrógeno con respecto a los electrones del oxígeno y los átomos que se están uniendo.
Explica que los átomos de oxígeno e hidrógeno que forman un enlace covalente comparten los electrones. Estos enlaces mantienen unidos al oxígeno y a los átomos de hidrógeno y forman la molécula H2O. La razón por la que los átomos logran unirse es que las atracciones son lo suficientemente fuertes en ambas direcciones y a que hay espacio para los electrones en el nivel externo de energía de los átomos.
El electrón de cada átomo de hidrógeno y los electrones del átomo de oxígeno logran aproximarse a más protones cuando los átomos están enlazados como una molécula que cuando se separan en átomos individuales. Esto hace que la molécula formada por átomos de oxígeno e hidrógeno enlazados sea más estable que los átomos individuales por separado.
Explica a los alumnos que los dos electrones en la unión entre el átomo de hidrógeno y el átomo de oxígeno pueden considerarse “pertenecientes” a cada átomo. Esto proporciona a cada átomo de hidrógeno dos electrones en su nivel externo de energía, que está completo. Asimismo, aporta oxígeno a 8 electrones en su nivel de energía externa, que también está completo.
Proyecta la animación Enlace covalente en agua.
Revisa con los alumnos el proceso de enlace covalente visto en la animación.
Paso 6
Haz que los alumnos describan el enlace covalente de una molécula de agua en su hoja de actividades.
Pide a los alumnos que escriban un texto breve junto a cada imagen para describir el proceso de enlace covalente en la molécula de agua.
Nota: Este modelo de enlace covalente para una molécula de agua comienza con 2 átomos de hidrógeno individuales y 1 átomo de oxígeno. En realidad, desde el inicio, estos átomos nunca están separados. Siempre están enlazados con algo más. Para simplificar el proceso, este modelo no muestra los átomos de hidrógeno y oxígeno rompiendo sus enlaces con respecto a otros átomos. Solo se enfoca en el proceso de formación de enlaces covalentes para formar agua.
Pregunta a los alumnos:
- ¿Por qué un tercer átomo de hidrógeno no puede unirse a la molécula de agua (H2O) para producir H3O?
Cuando los niveles externos de energía están completos, compartir electrones con otro átomo no sucedería por dos motivos principales: Un electrón de un nuevo átomo tendría que unirse a un átomo de la molécula de H2O en el siguiente nivel de energía, más lejos del núcleo, donde no sentiría una atracción lo suficientemente fuerte. Un electrón de un átomo que ya se encuentra en la molécula de H2O y cerca del núcleo debería alejarse más para compartir con el nuevo átomo. Ambas posibilidades harían que la molécula fuera menos estable y esto no ocurriría.
4 Explora
Paso 7
Pide a los alumnos que usen electricidad para formar oxígeno y gas hidrógeno a partir de agua.
Diles a los alumnos que la energía eléctrica hace que los electrones y los átomos de las moléculas de agua se reordenen y produzcan átomos de hidrógeno y átomos de oxígeno. Dos átomos de hidrógeno se unen para formar gas hidrógeno (H2) y dos átomos de oxígeno se unen para formar gas oxígeno (O2).
Nota: Es cierto que en la electrólisis del agua, los átomos de oxígeno y de hidrógeno de las moléculas de agua (H2O) eventualmente se convierten en gas hidrógeno (H2) y gas oxígeno (O2). Pero este es un proceso de muchos pasos y no una simple rotura de los enlaces covalentes en agua para volver a formar inmediatamente nuevos enlaces para fabricar los gases. Existen varios pasos intermedios.
Puedes optar por realizar esta actividad como una demostración o mostrar el video Electrólisis.
Pregunta para investigar
¿Qué se produce cuando se pone electricidad en agua?
Materiales para cada grupo
- Batería de 9 voltios
- 2 cables con pinzas cocodrilo en ambos extremos
- 2 lápices con punta en ambos extremos
- Agua
- Sal de Epsom (sulfato de magnesio)
- Vaso de plástico transparente
- Cinta
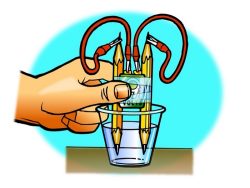
Procedimiento
- Coloca una batería entre 2 lápices. Asegúrate de que la batería esté más de la mitad hacia arriba.
- Con la ayuda de un compañero, envuelve los lápices y la batería con cinta, como se muestra.
- Agrega agua a un vaso de plástico transparente para que se llene aproximadamente hasta la mitad.
- Agrega aproximadamente ½ cucharadita de sal de Epsom al agua y revuelve hasta que la sal se disuelva.
- Conecta una pinza cocodrilo a uno de los terminales de la batería.
- Con el otro cable, conecta una pinza cocodrilo al otro terminal de la batería.
- Conecta un extremo de la mina del lápiz a la pinza cocodrilo en el extremo de uno de los cables.
- Con el otro cable, conecta un extremo de la otra mina del lápiz a la pinza cocodrilo en el extremo del cable.
- Coloca los extremos del lápiz en el agua como se muestra.
Resultados esperados
Al principio, se formarán burbujas y se elevarán desde la mina de uno de los lápices. Pronto, se formarán burbujas y se elevarán desde la otra. Los alumnos deben poder ver que hay más de un gas que del otro. El gas que forma las pequeñas burbujas que se desprenden primero es hidrógeno. El otro gas que forma las burbujas más grandes y se retrasa un poco es el oxígeno.
Nota: Habrá burbujeo cuando se forme gas hidrógeno y oxígeno en las minas de los lápices. Asegúrate de que los alumnos no adquieran una idea errónea de que las burbujas que ven significan que el agua está hirviendo. Al hervir, los enlaces que mantienen unidos a los átomos en moléculas de agua no se rompen. En el proceso de electrólisis, los enlaces que mantienen a los átomos juntos sí se rompen.
Paso 8
Analiza las observaciones de los alumnos.
Pregunta a los alumnos:
- ¿De qué están hechas las burbujas que se forman durante la actividad?
Gas hidrógeno (H2) y gas oxígeno (O2). - ¿Por qué se produjo más gas hidrógeno que gas oxígeno?
Cada molécula de agua se descompone en 2 átomos de hidrógeno y 1 átomo de oxígeno. Dos átomos de hidrógeno luego se enlazan para formar gas hidrógeno (H2) y dos átomos de oxígeno se enlazan para formar gas oxígeno (O2).
Cada molécula de agua tiene todos los átomos necesarios para producir 1 molécula de gas hidrógeno. Pero, con solo 1 átomo de oxígeno, una molécula de agua solo tiene la mitad de lo que se necesita para producir 1 molécula de gas oxígeno. Por lo tanto, 2 moléculas de agua producirán 2 moléculas de gas hidrógeno, pero solo 1 molécula de gas oxígeno.
5 Amplía
Paso 9
Ayuda a los alumnos a comprender cómo se combinan los átomos para formar las moléculas de oxígeno, metano y dióxido de carbono.
Recuerda a los alumnos que en esta lección analizaron los enlaces covalentes en moléculas de hidrógeno y en moléculas de agua. Diles que analizarán los enlaces covalentes en otras tres sustancias comunes.
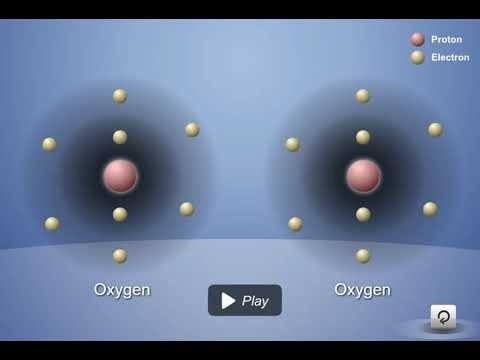
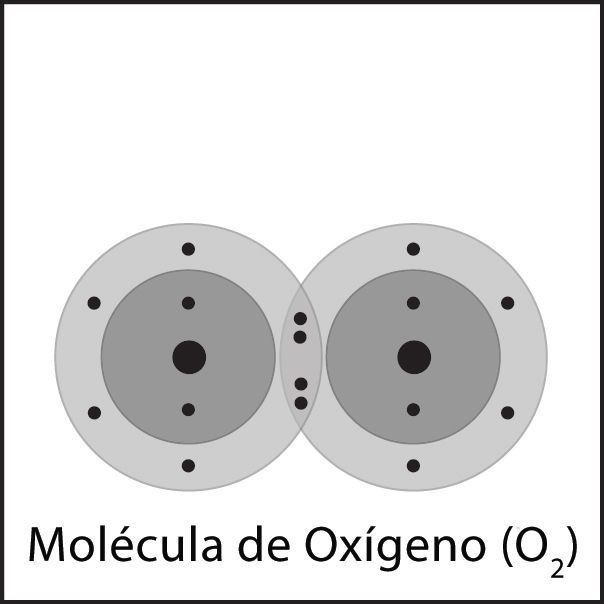
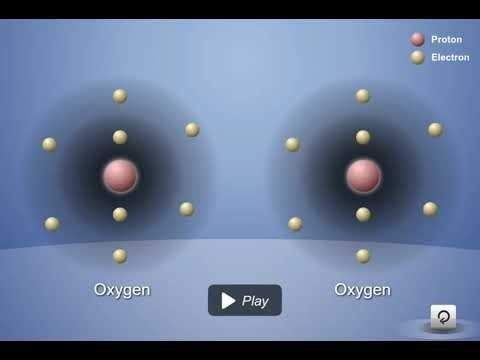
Proyecta la animación El doble enlace del oxígeno.
Cada átomo de oxígeno tiene 6 electrones de valencia en su nivel
Cuando dos átomos de oxígeno se acercan entre sí, las atracciones del núcleo de ambos átomos atraen a los electrones
En este caso, se comparten dos electrones de cada átomo. Esto se denomina doble enlace.
Explica a los alumnos que las moléculas de oxígeno que están presentes en nuestro aire están compuestas por 2 átomos de oxígeno. Esta animación mostrará cómo es el enlace covalente entre 2 átomos de oxígeno.
Narra la animación señalando que:
- Cada átomo de oxígeno tiene 6 electrones de valencia.
- Cuando los átomos de oxígeno se acercan entre sí, las atracciones del núcleo de ambos átomos atraen a los electrones del otro átomo.
- En este caso, se comparten dos electrones de cada átomo. Esto se denomina enlace covalente doble.
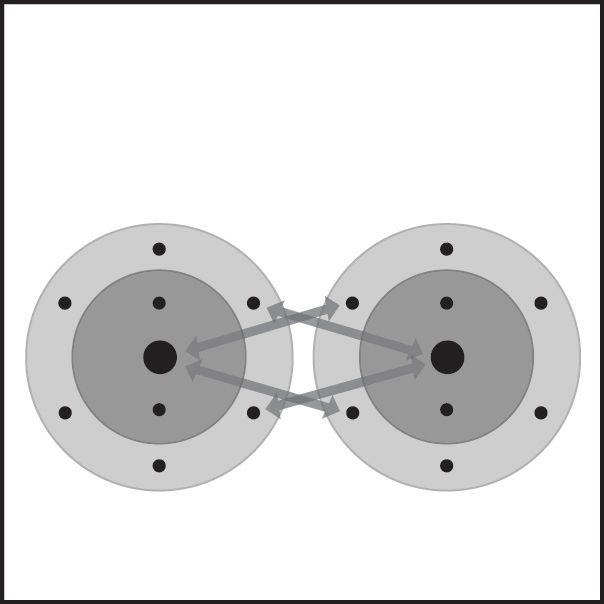
Proyecta la imagen El doble enlace del oxígeno II.
Revisa con los alumnos el proceso de enlace covalente visto en la animación.
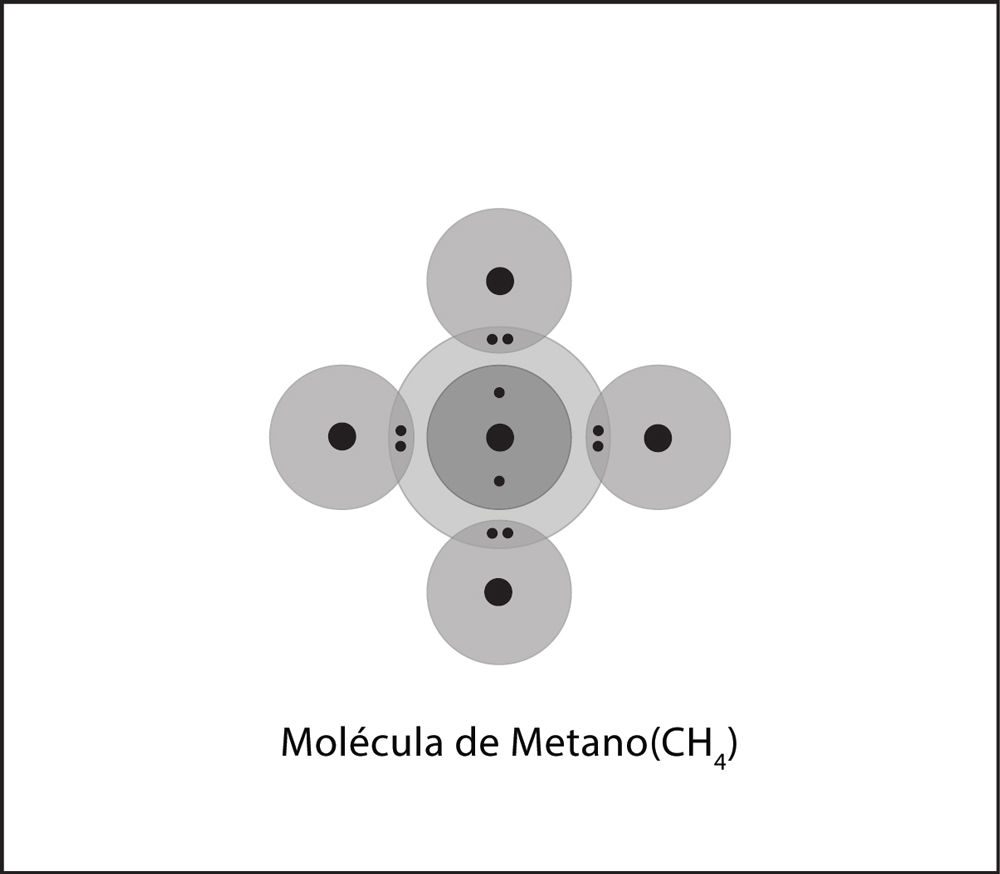
Proyecta las imágenes del antes y después Enlace covalente del metano.
Pregunta a los alumnos:
- Describe brevemente el proceso de enlace covalente entre el carbono y los cuatro átomos de hidrógeno para formar una molécula de metano. Asegúrate de mencionar las atracciones entre los electrones y los protones y la cantidad de electrones en el nivel externo de energía para los átomos de la molécula final.
Asegúrate de que los alumnos se den cuenta de que los protones de cada átomo atraen a los demás electrones de los átomos, lo que hace que los átomos se junten. Los átomos continúan enlazándose con otros átomos hasta que sus niveles externos de energía estén completos.
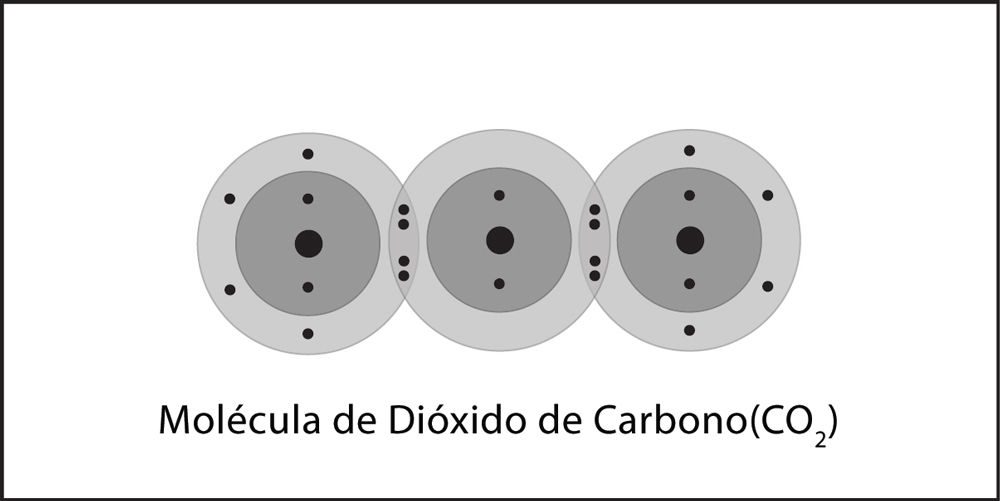
Proyecta las imágenes del antes y después Enlace covalente del gas dióxido de carbono.
Pregunta a los alumnos:
- Describe brevemente el proceso de enlace covalente entre el átomo de carbono y los dos átomos de oxígeno para formar una molécula de dióxido de carbono. Asegúrate de mencionar las atracciones entre los electrones y los protones y la cantidad de electrones en el nivel externo de energía para los átomos de la molécula final.
Asegúrate de que los alumnos se den cuenta de que los protones de cada átomo atraen a los electrones de los otros átomos, lo que une a los átomos. Los átomos continúan enlazándose con otros átomos hasta que sus niveles externos de energía estén completos.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Descargas
Para los estudiantes
- Lección 4.4 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 4.4 Plan de lección PDF | DOCX | Google Doc
- Lección 4.4 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
- Lección 4.4 Información contextual para el maestro PDF
- Capítulo 4 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 4 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda