Formación de un precipitado
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- Los iones o las moléculas de dos soluciones pueden reaccionar para formar un sólido.
- Un sólido formado a partir de dos soluciones se denomina precipitado.
Resumen
Los alumnos combinarán dos soluciones transparentes incoloras (solución de bicarbonato y solución de cloruro de calcio) y verán la formación de un sólido y un gas. Los alumnos analizarán la ecuación química de la reacción y verán que todos los átomos de los reactivos terminan en los productos. Entenderán la relación entre la ecuación química y las sustancias reales, y verán que el sólido y el gas producidos en la reacción real también están en los productos de la ecuación.
Objetivo
Los alumnos podrán explicar que, para que tenga lugar una reacción química, los reactivos interactúan, se rompen los enlaces entre ciertos átomos de los reactivos, se reorganizan los átomos y se forman nuevos enlaces entre los átomos para fabricar los productos. Los alumnos también podrán explicar que esta definición se aplica a la producción de un sólido llamado precipitado.

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas. Si realizas la demostración con solución de sulfato de cobre II, amoníaco y peróxido de hidrógeno al final de la lección, vierte la solución resultante y el precipitado en un vaso o vaso de precipitado y deja que se evapore. Coloca la pequeña cantidad de sólido en una toalla de papel y deséchala en la basura o utiliza un método de eliminación requerido por la normativa local. El carbonato de sodio puede irritar la piel. Lávate las manos después de la actividad. El polvo de sulfato de magnesio puede irritar las vías respiratorias.
Sigue todas las precauciones de seguridad relativas al uso, almacenamiento y eliminación de sulfato de cobre II y carbonato de sodio.
Materiales para las demostraciones
- Carbonato de sodio
- Sal de Epsom (sulfato de magnesio)
- 2 vasos de plástico transparente
- Tubo de ensayo
- Agua
- Sulfato de cobre II
- Amoníaco doméstico
- Peróxido de hidrógeno (3 %)
- Cilindro graduado
- 2 goteros
Materiales para cada grupo
- Bicarbonato
- Cloruro de calcio
- Agua
- Cilindro graduado
- Cuchara medidora (½ cucharadita) o balanza
- 2 vasos de plástico transparente
- Cinta de enmascarar
- Bolígrafo
Descarga todos los recursos de la Lección 6.3
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 6.3: Formación de un precipitado."
Instrucciones
1 Involúcrate
Paso 1
Realiza una demostración combinando dos soluciones transparentes incoloras que producen un sólido blanco y presenta el término precipitado.
Materiales para la demostración
- Sal de Epsom (sulfato de magnesio)
- Carbonato de sodio
- Agua
- 2 vasos de plástico transparente
- 1 cucharada
- 1 cucharadita
Preparación del maestro
- Vierte 100 ml de agua en un vaso de plástico transparente y añade 10 g (aproximadamente 1 cucharada) de sulfato de magnesio. Remueve hasta que la solución esté transparente.
- Vierte 50 ml de agua en otro vaso de plástico transparente y añade 5 g (aproximadamente 1 cucharadita) de carbonato de sodio. Remueve hasta que la solución esté transparente.

Procedimiento
- Sostén las dos soluciones transparentes incoloras y vierte lentamente la cantidad más pequeña en la más grande.
Resultados esperados
Se formarán partículas de un sólido blanco.
Pregunta a los alumnos:
- ¿Considerarían que añadir una solución de carbonato de sodio a una solución de sulfato de magnesio es una reacción química?
Sí.
¿Por qué sí o por qué no?
La combinación de los dos líquidos transparentes incoloros es un cambio químico porque se forma una sustancia sólida diferente.
Diles a los alumnos que un precipitado es un sólido insoluble que se forma cuando se combinan dos soluciones y estas reaccionan químicamente. Insoluble significa que el sólido no se disuelve.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 6.3 Hoja de actividades PDF | DOCX | Google Doc
- Lección 6.3 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Observa la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explora
Paso 2
Haz que los alumnos combinen dos líquidos para observar otro precipitado.
Pregunta para investigar
¿Cómo saben cuándo se forma un precipitado en una reacción química?
Materiales para cada grupo
- Bicarbonato
- Cloruro de calcio
- Agua
- Cilindro graduado
- Cuchara medidora (½ cucharadita) o balanza
- 2 vasos de plástico transparente
- Cinta de enmascarar
- Bolígrafo
Nota: Si deseas que los alumnos practiquen utilizando una balanza para pesar en gramos, pídeles que pesen dos gramos de bicarbonato y de cloruro de calcio.

Procedimiento
- Utiliza cinta adhesiva y un bolígrafo para etiquetar 2 vasos de plástico Solución de bicarbonato y solución de cloruro de calcio.
- Usa un cilindro graduado para añadir 20 ml de agua a cada vaso.
- Añade 2 g (aproximadamente ½ cucharadita) de cloruro de calcio al agua en su recipiente etiquetado. Remueve hasta que la mayor parte del cloruro de calcio se haya disuelto, en la medida de lo posible.
- Añade 2 g (aproximadamente ½ cucharadita) de bicarbonato en el recipiente etiquetado. Remueve hasta que la mayor parte del bicarbonato se haya disuelto. Pueden quedar restos de bicarbonato sin disolver en el fondo del vaso.
- Vierte con cuidado la solución de bicarbonato en la solución de cloruro de calcio. Intenta no verter nada del bicarbonato sin disolver. Observa.
Resultados esperados
Aparecen burbujas y un precipitado blanco.
Paso 3
Analiza las observaciones de los alumnos.
Pregunta a los alumnos:
- ¿Qué observaron al mezclar la solución de bicarbonato y la solución de cloruro de calcio?
Las soluciones formaron burbujas y se formaron pequeñas partículas blancas sólidas. - ¿Observaste un precipitado?
Sí. Las partículas blancas aparecieron después de combinar las dos soluciones. - ¿Creen que esto fue una reacción química? Sí. ¿Por qué?
Las dos sustancias que se combinaron eran líquidos y las sustancias que se produjeron eran un sólido y un gas. Estos productos parecen ser diferentes de los reactivos.
4 Explica
Paso 4
Comenta los productos generados en esta reacción química.
Recuerda a los alumnos que, en las reacciones químicas que han visto hasta ahora, ciertos átomos en las moléculas reactivas rompen sus enlaces y luego se reorganizan y vuelven a enlazarse de diferentes maneras para formar los productos. Vieron que en los reactivos había el mismo tipo y cantidad de átomos que en los productos.
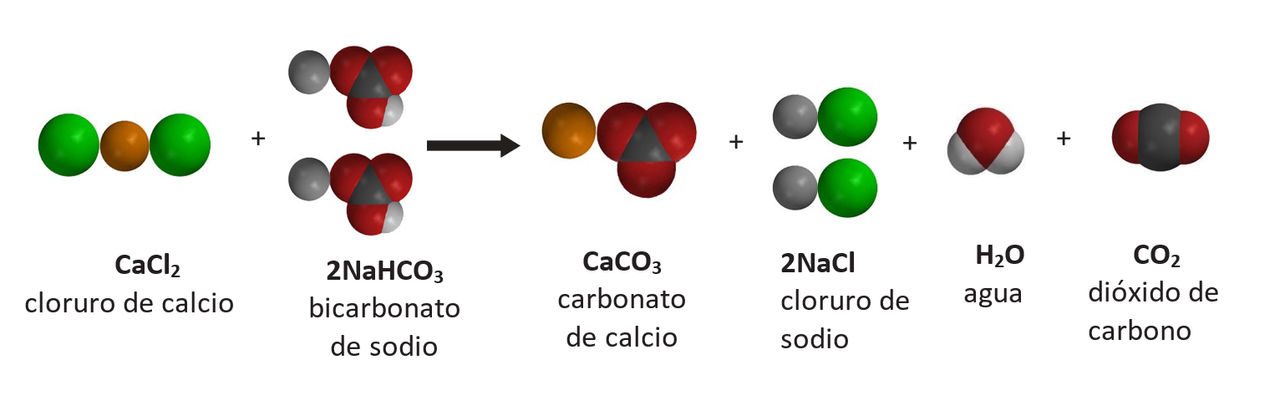
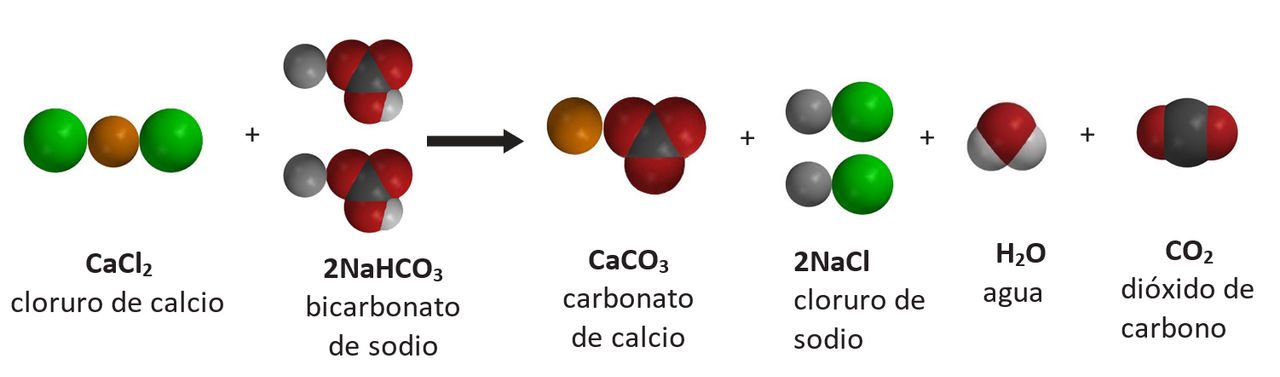
Proyecta la imagen Cloruro de calcio y bicarbonato de sodio.
Pregunta a los alumnos:
- ¿Qué productos de la reacción reconocen?
Los alumnos deben reconocer el cloruro de sodio (NaCl), el agua (H2O) y el dióxido de carbono (CO2). - Observa el lado del producto de la ecuación química. ¿Qué gas se produce en la reacción química?
Gas de dióxido de carbono. - ¿Cuál crees que es el precipitado?
Como solución, la sal y el agua son transparentes e incoloros, por lo que el precipitado debe ser CaCO3, que es el carbonato de calcio. Diles a los alumnos que el carbonato de calcio es la tiza normal. - ¿Cuántos de cada tipo de átomo hay en el lado de los reactivos de la ecuación?
1 átomo de calcio, 2 átomos de cloro, 2 átomos de sodio, 2 átomos de hidrógeno, 2 átomos de carbono y 6 átomos de oxígeno. - ¿Cuántos de cada tipo de átomo hay en el lado del producto de la ecuación química?
1 átomo de calcio, 2 átomos de cloro, 2 átomos de sodio, 2 átomos de hidrógeno, 2 átomos de carbono y 6 átomos de oxígeno. - ¿Se trata de una ecuación química equilibrada? Si es así, ¿cómo lo sabes?
Sí. El mismo tipo y cantidad de átomos se encuentran en los reactivos y en los productos.
Asegúrate de que los alumnos vean que todos los tipos de átomos del lado izquierdo de la ecuación también se encuentran a la derecha. Asegúrate también de que vean que hay una cantidad igual de cada tipo a ambos lados de la ecuación.
5 Explora
Paso 5
Separa los productos para mostrar que el precipitado es un sólido.
Pregunta a los alumnos:
- ¿Cómo creen que podríamos separar el precipitado de los otros productos?
Coloca todo en un filtro y deja que el líquido pase.
Pregunta para investigar
¿Puedes separar el carbonato de calcio del resto de los productos?
Materiales para cada grupo
- Filtro de café o toalla de papel
- Vaso alto de plástico transparente

Procedimiento
- Utiliza un filtro de café lo suficientemente grande (o una toalla de papel) para que puedas introducir aproximadamente ⅓ de su recorrido en el vaso y aun así tener suficiente capacidad para sujetarlo alrededor de la parte de afuera del vaso.
- Mientras sujetas el filtro de café en su sitio, vierte los productos en el centro del filtro de café.
- Deja que el líquido gotee a través del filtro. Esto puede tardar entre 5 y 10 minutos.
- Deja el precipitado a un lado y permite que el agua se evapore.
Resultados esperados
Quedará un sólido blanco en el filtro de café. Después de que el agua se evapore, el carbonato de calcio será un polvo blanco.
Nota: Si deseas separar el cloruro de sodio del agua que fluyó a través del filtro, vierte el líquido en un vaso vacío limpio y deja que el agua se evapore durante unos días. A medida que el agua se evapora, los alumnos comenzarán a ver cristales de sal con forma cúbica que se forman en la solución. Finalmente, solo los cristales de sal permanecerán en el vaso.
Pregunta a los alumnos:
- ¿Qué es la sustancia blanca sólida que hay en el papel?
Carbonato de calcio (tiza). - ¿Filtrar el carbonato de calcio y permitir que el agua se evapore es un cambio químico o un cambio físico?
Es un cambio físico. - ¿Por qué?
Estas sustancias ya estaban presentes en el agua, por lo que no se fabrican nuevos productos químicos. - ¿Qué pruebas había de que se produjera una reacción química al combinar la solución de bicarbonato y la solución de cloruro de calcio?
Se formaron un gas y un sólido blanco.
Paso 6
Confirma que se ha producido una reacción química.
Pregunta a los alumnos:
- ¿Cómo podríamos comparar el precipitado con los reactivos para asegurarnos de que el precipitado es realmente diferente de ambos?Realiza una prueba de solubilidad en las tres sustancias.
Pregunta para investigar
¿La solubilidad del precipitado es diferente de la solubilidad del bicarbonato y del cloruro de calcio?
Pregunta a los alumnos:
¿Cómo debemos armar la prueba de solubilidad?
- ¿Deberíamos usar la misma cantidad de cada sustancia?
Sí. - ¿Deberíamos usar la misma cantidad de agua?
Sí.
Materiales para cada grupo
- Precipitado seco en una toalla de papel
- Balanza
- 3 vasos de plástico pequeños
- Cilindro graduado
- ¼ de cucharadita
- Palito de helado (opcional)
- Cloruro de calcio
- Bicarbonato
- Agua

Procedimiento
- Etiqueta 3 vasos con los nombres “bicarbonato de sodio”, “cloruro de calcio” y “precipitado”.
- Utiliza una cuchara o un palito de helado para raspar el precipitado para formar una pila.
- Toma ¼ de cucharadita de precipitado lo más llena posible. Coloca el ¼ de cucharadita de precipitado en el vaso etiquetado correspondiente.
- Coloca ¼ de cucharadita de bicarbonato de sodio y de cloruro de calcio en los vasos etiquetados correspondientes.
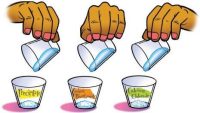
- Añade 25 ml de agua a cada vaso y agítalo suavemente hasta que los sólidos se disuelvan lo más posible. Observa la cantidad de sólido que permanece sin disolver en cada vaso.
Resultados esperados
El bicarbonato de sodio y el cloruro de calcio se disuelven, pero el precipitado no.
Dado que el precipitado no se disuelve como lo hacen los reactivos, debe ser una sustancia diferente de los reactivos. Por lo tanto, debe haberse producido una reacción química.
6 Amplía
Paso 7
Haz una demostración para mostrar a los alumnos otro ejemplo de un precipitado y un cambio de color.
Diles a los alumnos que les mostrarás otra reacción que forma un precipitado y algo más.
Materiales para la demostración
- Sulfato de cobre II
- Amoníaco doméstico
- Peróxido de hidrógeno (3 %)
- Agua
- Cilindro graduado
- Tubo de ensayo
- 2 goteros
- 1 vaso de plástico transparente (vacío)
Nota: El compuesto de cobre se denomina “cobre II” porque el cobre puede producir diferentes tipos de iones. Puede perder un electrón y ser solo Cu+ o puede perder dos electrones y ser Cu 2+. Este tipo de ion de cobre se denomina cobre II. El “sulfato” en el sulfato de cobre II es, además, un ion. Este ion está compuesto por más de un átomo. Es uno de los iones poliatómicos analizados en el Capítulo 4, Lección 3. El ion de sulfato está compuesto por un átomo de azufre unido a cuatro átomos de oxígeno y es tratado como un ion (SO42−).
Preparación del maestro
Haz una solución de sulfato de cobre II añadiendo 5 g de sulfato de cobre II a 50 ml de agua.
Procedimiento
- Vierte entre 15 y 20 ml de solución de sulfato de cobre II en un tubo de ensayo para que se llene aproximadamente hasta la mitad.
- Añade unas 10 a 20 gotas de amoníaco.
- Añade unas 10 a 20 gotas de peróxido de hidrógeno.
Resultados esperados
Después de añadir el amoníaco, se formará un precipitado blanquecino en la parte superior de la solución de sulfato de cobre II. A medida que se añade más amoniaco, el color de la parte superior del líquido cambiará a un color azul más oscuro y profundo. A medida que se añade el peróxido de hidrógeno, el área azul oscura en la parte superior de la solución se volverá de color verde oscuro y se formará un precipitado oscuro.
Nota: Los detalles de las reacciones químicas que producen los diferentes precipitados y los diferentes cambios de color son complicados. La idea principal para los alumnos es que los átomos o grupos de átomos en los reactivos se reorganizan y enlazan de diferentes maneras para formar diferentes sustancias en los productos.
Hazles saber a los alumnos que cuando ven la producción de un gas, un precipitado o un cambio de color, se trata de evidencia de que se ha producido una reacción química.
Pregunta a los alumnos:
- ¿Cómo puedes darte cuenta de que se generó algo nuevo cuando reaccionaron el sulfato de cobre II y el amoníaco?
Se produjo un precipitado. - ¿Cómo puedes darte cuenta de que se fabricó algo nuevo cuando estas sustancias reaccionaron con peróxido de hidrógeno?
El cambio de color y otros precipitados son indicios de otra reacción química.
Proyecto en clase o en casa.
Haz que los alumnos usen objetos como gomitas, esferas, M&M, Legos u otros objetos pequeños para representar los átomos en dos de las tres reacciones que han explorado hasta ahora. Los alumnos pueden pegar los objetos en la cartelera y escribir la fórmula química de los reactivos y productos.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Simulaciones
Vea todas las imágenes de la Lección 6.3 en la página de simulaciónes.
Descargas
Para los estudiantes
- Lección 6.3 Hoja de actividades PDF | DOCX | Google Doc
Para los Maestros
- Lección 6.3 Plan de lección PDF | DOCX | Google Doc
- Lección 6.3 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Recursos para el Capítulo 6
- Capítulo 6 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 6 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda