Controlar la cantidad de productos en una reacción química
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- Cambiar la cantidad de reactivos afecta la cantidad de productos generados en una reacción química.
- En una reacción química, solo los átomos presentes en los reactivos pueden acabar en los productos.
- En una reacción química, la masa se conserva.
Resumen
Los alumnos analizarán la ecuación química para la reacción entre el vinagre (solución de ácido acético) y el bicarbonato (bicarbonato de sodio). Establecerán la conexión entre la ecuación química escrita, el modelo molecular y las sustancias reales en la reacción. Los alumnos verán que el gas producido en la reacción real también está escrito en los productos de la ecuación. Los alumnos también cambiarán la cantidad de uno o más reactivos y comprobarán cómo afecta el cambio a la cantidad de productos.
Objetivo
Los alumnos podrán explicar que, para que tenga lugar una reacción química, los enlaces entre los átomos de los reactivos se rompen, los átomos se reorganizan y se forman nuevos enlaces entre los átomos para fabricar los productos. Los alumnos podrán contar el número de átomos del lado del reactivo y del lado del producto en una ecuación química. También podrán explicar que la misma cantidad de átomos a cada lado de la ecuación muestra que, durante una reacción química, la masa se conserva.
Los alumnos también podrán explicar, a nivel molecular, por qué cambiar la cantidad de uno o más reactivos cambia la cantidad de productos. También podrán explicar por qué añadir más y más de un reactivo finalmente no generará productos adicionales.

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas. Utiliza el vinagre en una sala bien ventilada. Pide a los alumnos que se laven las manos después de la actividad.
Materiales para las demostraciones
- Vinagre
- Bicarbonato
- Agua
- Alka-Seltzer
- Solución de detergente
- Cilindro graduado (50 ml)
- Cilindro graduado, (100 ml)
- Cuchara medidora (½ cucharadita)
- 1 vaso de plástico transparente
- Vaso pequeño
- Gotero
- Recipiente de plástico para desechos
Materiales para cada grupo
- Vinagre en un vaso
- Bicarbonato en un vaso
- Solución de detergente en un vaso
- Gotero
- Cilindro graduado (50 ml)
- Cucharas medidoras (⅛, ¼, y ½ cucharadita)
- Recipiente de plástico para desechos
Descarga todos los recursos de la Lección 6.2
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 6.2: Controlar la cantidad de productos en una reacción química."
Instrucciones
1 Involúcrate
Paso 1
Pide a los alumnos que miren la ecuación química de la reacción entre el vinagre y el bicarbonato mientras comentas sobre los reactivos.
Recuerda a los alumnos que, en la última lección, aprendieron que, en una reacción química, ciertos átomos de las moléculas reactivas rompen sus enlaces y luego se reorganizan y vuelven a enlazar de diferentes maneras para formar los productos. Los alumnos vieron que el mismo tipo y la misma cantidad de átomos que había en los reactivos también se encontraba en los productos. Hazles saber a los alumnos que, aunque la reacción en esta lección parece más complicada, estos mismos principios siguen siendo aplicables.
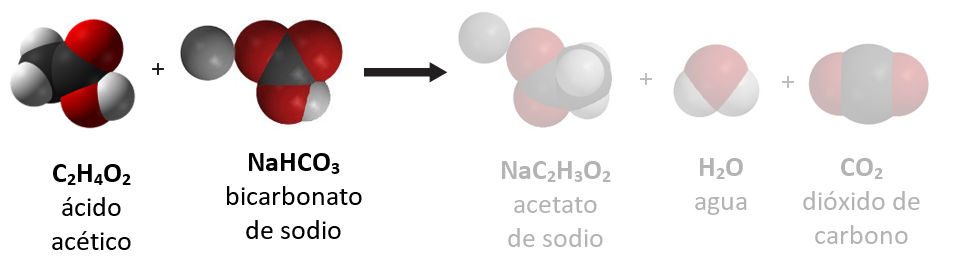
Proyecta la imagen Reactivos.
Muestra a los alumnos la ecuación química para la reacción entre el vinagre y el bicarbonato.
Pregúntales a los alumnos acerca del vinagre:
- El ácido acético mezclado con agua es vinagre. Normalmente, el vinagre es una solución de aproximadamente el 5 % de ácido acético y el 95 % de agua. Cuando un reactivo se encuentra en una solución, normalmente el agua no se menciona como reactivo. ¿Qué átomos componen una molécula de ácido acético (vinagre)?
Carbono, hidrógeno y oxígeno (C, H y O). - ¿Qué significan los números pequeños que aparecen a continuación y a la derecha de cada letra?
Es la cantidad de ese átomo en particular en la molécula de ácido acético. Hay dos átomos de carbono, cuatro átomos de hidrógeno y dos átomos de oxígeno en una molécula de ácido acético. - ¿Creen que cada molécula de ácido acético tiene esta fórmula?
Sí. La fórmula química para una sustancia es única de esa sustancia y define lo que es.
Pregunta a los alumnos sobre el bicarbonato:
- El bicarbonato de sodio es el que se usa en la cocina. ¿De qué átomos está hecho el bicarbonato de sodio?
Sodio, hidrógeno, carbono y oxígeno (Na, H, C y O). - ¿Cuántos de cada tipo de átomo hay en el compuesto bicarbonato de sodio?
Hay un átomo de sodio, un átomo de hidrógeno, un átomo de carbono y tres átomos de oxígeno en cada unidad de bicarbonato de sodio.
Paso 2
Como demostración, combina vinagre y bicarbonato para mostrarles a los alumnos la reacción química descrita en la ecuación.
Materiales para la demostración
- Vinagre
- Cilindro graduado (50 ml)
- Bicarbonato
- Vaso de plástico transparente

Procedimiento
- Usa un cilindro graduado para medir 10 ml de vinagre.
- Coloca aproximadamente ½ cucharadita de bicarbonato en un vaso de plástico transparente.
- Mientras los alumnos miran, vierte el vinagre en el bicarbonato.
Resultados esperados
Se formarán burbujas que subirán por el vaso.
Pregunta a los alumnos:
- Se combinaron un líquido y un sólido y vieron burbujas, que están hechas de gas. ¿Creen que se ha producido una reacción química? ¿Por qué?
Se produjo una reacción química porque, cuando se combinaron los reactivos, se produjo una sustancia diferente.
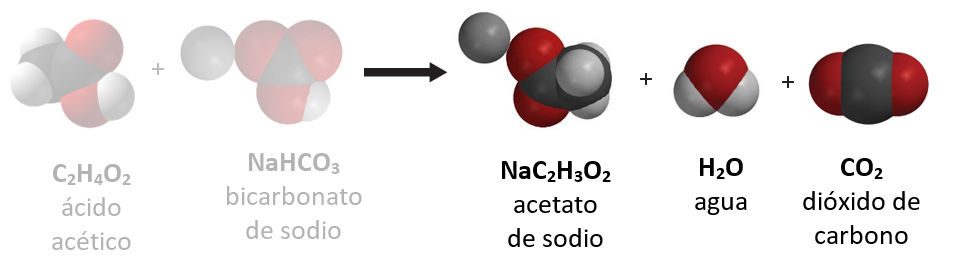
Proyecta la imagen Productos.
Señala los productos en la reacción química.
Pregunta a los alumnos:
- Observa la ecuación química. ¿Cuál es el gas producido en la reacción química entre el vinagre y el bicarbonato?
Dióxido de carbono - ¿Qué más se produce en esta reacción química?
Cuando el vinagre y el bicarbonato reaccionan, los átomos se reorganizan para formar acetato de sodio (el sabor salado y ácido en las patatas fritas con sabor a sal y vinagre), agua y dióxido de carbono.
Continúa proyectando la ecuación química mientras, junto con los alumnos, cuentas la cantidad de átomos tanto del lado del reactivo como del lado del producto de la ecuación.
Paso 3
Revisa el concepto de que, en una reacción química, la masa se conserva.
Ayuda a los alumnos a contar los átomos en los reactivos y en los productos de la reacción entre el vinagre y el bicarbonato. Asegúrate de que los alumnos vean que todos los tipos de átomos del lado izquierdo de la ecuación también se encuentran a la derecha. Asegúrate también de que vean que hay una cantidad igual de cada tipo a ambos lados de la ecuación.
Orienta a los alumnos mientras responden juntos las siguientes preguntas:
- ¿Todos los tipos de átomos que están del lado izquierdo de la ecuación también están del lado derecho de la ecuación? Sí. ¿Por qué?
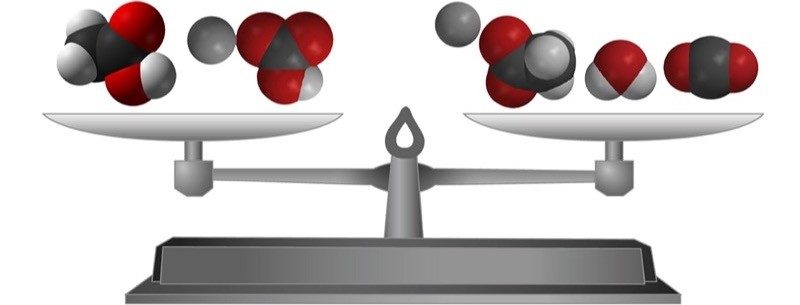
Los átomos de los reactivos se reorganizan para formar los productos. En una reacción química, no se crean ni se destruyen átomos. - En la ecuación, ¿cuántos de cada tipo de átomo hay del lado de los reactivos?
3 átomos de carbono, 5 átomos de hidrógeno, 5 átomos de oxígeno y 1 átomo de sodio. - En la ecuación, ¿cuántos de cada tipo de átomo hay del lado del producto?
3 átomos de carbono, 5 átomos de hidrógeno, 5 átomos de oxígeno y 1 átomo de sodio.
Proyecta la imagen La masa se conserva.
Señala que el tipo y la cantidad de átomos en los reactivos y en los productos es exactamente igual. Este es un concepto importante en química: en una reacción química, todos los átomos presentes en los reactivos acaban en los productos. Cuando se escribe una ecuación de una reacción química, se “equilibra” para mostrar esto. Una ecuación química equilibrada muestra que no se destruyen átomos y no se crean nuevos átomos en la reacción química. Explica a los alumnos que otra forma de decir que no se crean ni destruyen átomos en una reacción química es que la masa se conserva.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 6.2 Hoja de actividades PDF | DOCX | Google Doc
- Lección 6.2 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Observa la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explora
Paso 4
Como demostración, combina vinagre, detergente y el bicarbonato en un cilindro graduado de modo que suba espuma y se derrame por el borde.
Preparación del maestro para la demostración y para cada grupo
- Prepara una solución detergente añadiendo 1 cucharadita de detergente líquido a 2 cucharadas de agua. Divide esta solución detergente en partes iguales en un vaso pequeño para cada grupo.
- Coloca aproximadamente 1 cucharada de vinagre en un vaso pequeño para cada grupo.
- Coloca unas 2 cucharaditas de bicarbonato en un vaso pequeño para cada grupo.
Materiales para la demostración
- Vinagre
- Bicarbonato
- Solución detergente
- Gotero
- Cilindro graduado (50 ml)
- Cuchara medidora (½ cucharadita)
- Recipiente de plástico para desechos
- Vaso pequeño
Procedimiento
- Usa un cilindro graduado para medir 10 ml de vinagre.
- Vierte el vinagre en un vaso pequeño y añade 1 gota de detergente. Agita suavemente para mezclar.
- Añade ½ cucharadita de bicarbonato al cilindro graduado vacío.
- Coloca el cilindro graduado en un recipiente de plástico para desechos.
- Vierte el vinagre y el detergente del vaso en el cilindro graduado. Pide a los alumnos que observen el nivel de espuma en el cilindro graduado.
- Enjuaga el cilindro graduado sobre el recipiente de desechos.
Resultados esperados
Subirá espuma blanca por el cilindro graduado y se desbordará.
Paso 5
Comenta cómo cambiar la cantidad de espuma producida para que suba a la parte superior del cilindro sin desbordarse.
Pregunta a los alumnos:
- ¿Qué podrían cambiar para crear una espuma que se eleve lo más cerca posible de la parte superior del cilindro sin desbordarse?
Los alumnos pueden mencionar variables como:- La cantidad de vinagre, de detergente o de bicarbonato.
- El orden en el que las sustancias se añaden al cilindro graduado.
Explica que la cantidad de detergente no debe variar en esta actividad porque se utiliza como indicador para ayudar a medir la cantidad de gas producido en la reacción. Además, primero debe añadirse el bicarbonato al cilindro. Después se vierte el vinagre para obtener una mejor mezcla de los reactivos.
Recuerda a los alumnos que 10 ml de vinagre y ½ cucharadita de bicarbonato causaron que la espuma se desborde. Los alumnos deben tener en cuenta estas cantidades mientras planifican la cantidad de cada reactivo que utilizarán al comenzar sus pruebas.
Pregunta a los alumnos:
- ¿Pueden añadir primero el bicarbonato y después el vinagre para una prueba, y luego cambiar el orden para las otras? No. ¿Por qué no?
Todas las pruebas deben realizarse de la misma manera. Por ejemplo, en la demostración se colocó bicarbonato en el cilindro graduado antes de añadir el vinagre y el detergente. Este método mezcla bien el bicarbonato y el vinagre. Todas las pruebas nuevas deben realizarse de esta misma manera. - ¿Se debe enjuagar el cilindro graduado cada vez? Sí. ¿Por qué?Cualquier producto o reactivo sobrante que permanezca en el cilindro graduado puede afectar la siguiente reacción. Es mejor enjuagar el cilindro después de cada prueba.
- ¿Cómo recordarán las cantidades utilizadas en cada prueba?
Los alumnos deben darse cuenta de la necesidad de realizar y registrar mediciones precisas en la tabla proporcionada.
Paso 6
Haz que cada grupo experimente con diferentes cantidades de vinagre y bicarbonato para que la espuma suba hasta la parte superior del cilindro graduado sin desbordarse.
Diles a los alumnos que deben intentar que la espuma se detenga lo más cerca posible de la parte superior del cilindro sin desbordarse. Puedes optar por limitar a los alumnos a un máximo de tres intentos o dejarles experimentar más si el tiempo y los suministros lo permiten.
Pregunta para investigar
¿Cómo puedes fabricar la cantidad justa de espuma que llegue hasta la parte superior del cilindro graduado sin que se desborde?
Materiales para cada grupo
- Vinagre en un vaso
- Bicarbonato en un vaso
- Solución de detergente en un vaso
- Gotero
- Cilindro graduado (50 ml)
- Cucharas medidoras (⅛, ¼, y ½ cucharadita)
- Recipiente de plástico para desechos
Procedimiento
- Decide cuánto vinagre y bicarbonato usarás, y anota estas cantidades en la tabla de la hoja de actividades.
- Utiliza un cilindro graduado para medir la cantidad de vinagre que tu grupo acordó.
- Vierte el vinagre en un vaso pequeño y añade 1 gota de detergente. Agita suavemente para mezclar.
- Añade la cantidad de bicarbonato que tu grupo haya acordado en el cilindro graduado vacío.
- Coloca el cilindro graduado en un recipiente de plástico para desechos.

- Vierte el vinagre y el detergente, desde el vaso hasta el cilindro graduado. Observa el nivel de espuma en el cilindro graduado.
- Enjuaga el cilindro graduado sobre el recipiente de desechos.
Resultados esperados
Usar ⅛ cucharadita de bicarbonato, 5 ml de vinagre y 1 gota de detergente probablemente hará que la espuma se eleve a la parte superior del cilindro sin desbordarse. Los resultados pueden variar.
Pide a los grupos que compartan sus conclusiones sobre las cantidades de bicarbonato y vinagre que se acercaron más a la parte superior del cilindro. ¿Utilizó cada grupo cantidades similares de bicarbonato y vinagre?
4 Explica
Paso 7
Comenta por qué ajustar la cantidad de reactivos afecta la cantidad de productos.
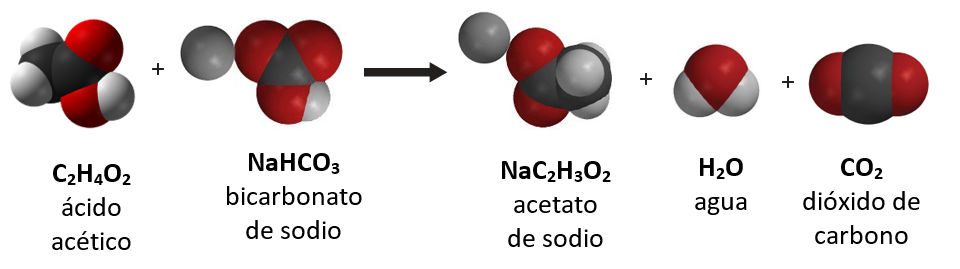
Proyecta la imagen Controlar la cantidad de productos formados.
Muestra a los alumnos la ecuación química para la reacción entre el vinagre y el bicarbonato.
Pregunta a los alumnos:
- ¿Por qué, a nivel molecular, cambiar la cantidad de bicarbonato o de vinagre afecta la cantidad de gas de dióxido de carbono producido?
Los productos se fabrican a partir de reactivos, por lo que añadir más reactivos generará más productos.
El punto importante que deben tener en cuenta los alumnos es que los átomos de ambos reactivos son necesarios para generar los productos. El uso de menos bicarbonato, por ejemplo, produce menos gas de dióxido de carbono porque hay menos átomos de bicarbonato para producir el dióxido de carbono. En general, usar más de uno o más reactivos dará lugar a más de uno o más productos. Usar menos de uno o más reactivos dará lugar a menos de uno o más productos. Hazles saber a los alumnos que este principio tiene límites.
Nota: No es necesario que los alumnos de nivel medio sepan qué átomo de los reactivos en particular terminó en qué producto. Puede parecer extraño, pero a veces un producto puede estar compuesto por átomos de un solo reactivo. En la reacción del vinagre y el bicarbonato, los átomos del CO2 solo proceden del bicarbonato de sodio.
Pregunta a los alumnos:
- ¿Qué harías si quisieras producir más dióxido de carbono?
Añadir más vinagre y más bicarbonato. - ¿Se podría seguir añadiendo cada vez más bicarbonato a la misma cantidad de vinagre para obtener más dióxido de carbono?
No. Esto podría funcionar durante un tiempo, siempre que haya más vinagre, pero finalmente no quedarían átomos de vinagre que reaccionen con el bicarbonato extra, por lo que no se produciría más dióxido de carbono.
5 Amplía
Paso 8
Realiza una demostración utilizando un comprimido de Alka-Seltzer o un comprimido efervescente similar en agua para demostrar que el ácido cítrico reacciona con el bicarbonato de sodio para producir gas de dióxido de carbono.
Informa a los alumnos que un comprimido de Alka-Seltzer contiene aspirina, bicarbonato de sodio y ácido cítrico. El ácido cítrico interactúa con el bicarbonato de sodio de forma similar a como el ácido acético del vinagre interactúa con el bicarbonato de sodio.
Pide a los alumnos que hagan una predicción:
- ¿Qué sucederá cuando se coloque un comprimido de Alka-Seltzer en agua con una gota de solución detergente?
Materiales para la demostración
- Alka-Seltzer
- Agua
- Cilindro graduado (100 ml)
- Solución detergente
- Gotero

Procedimiento
- Coloca 50 ml de agua en un cilindro graduado de 100 ml.
- Añade 1 gota de solución detergente y agítala suavemente para mezclar.
- Deja caer la mitad de un comprimido de Alka-Seltzer en el cilindro graduado.
- Coloca el cilindro graduado en un recipiente de plástico para desechos.
Resultados esperados
La espuma blanca aumentará en el cilindro graduado y se desbordará a medida que el comprimido se haga más pequeño.
Pregunta a los alumnos:
- ¿Creen que esta es una reacción química? Sí. ¿Por qué?
Porque se produjo un gas. Este gas no estaba en uno de los reactivos, por lo que debe haberse producido durante la reacción química. - ¿Por qué creen que esta reacción es similar a la reacción del vinagre y el bicarbonato?
El ácido cítrico y el vinagre son ácidos y, por lo tanto, interactúan con el bicarbonato de sodio de forma similar para producir gas de dióxido de carbono.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Simulaciones
Vea todas las imágenes de la Lección 6.2 en la página de simulaciónes.
Descargas
Para los estudiantes
- Lección 6.2 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 6.2 Plan de lección PDF | DOCX | Google Doc
- Lección 6.2 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Recursos para el Capítulo 6
- Capítulo 6 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 6 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda