¿Qué es una reacción química?
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave:
- Un cambio físico, como un cambio de estado o una disolución, no crea una nueva sustancia, pero sí genera un cambio químico.
- Un cambio químico es el resultado de una reacción química.
- En una reacción química, los átomos y las moléculas que interactúan entre sí se llaman reactivos.
- En una reacción química, los átomos y moléculas producidos por la reacción se denominan productos.
- En una reacción química, solo los átomos presentes en los reactivos pueden acabar en los productos. No se crean nuevos átomos y no se destruye ningún átomo.
- En una reacción química, los reactivos entran en contacto entre sí, se rompen los enlaces entre los átomos de los reactivos y los átomos se reorganizan y forman nuevos enlaces para hacer los productos.
Resumen
El maestro utilizará la pequeña llama de una vela para demostrar una reacción química entre la cera de vela y el oxígeno del aire. Los alumnos verán una animación molecular de la combustión del metano y el oxígeno como modelo de una reacción similar. Utilizarán recortes del modelo de átomo para modelar la reacción y verán que todos los átomos de los reactivos aparecen en los productos.
Objetivo
Los alumnos podrán explicar que, para que tenga lugar una reacción química, los enlaces entre los átomos de los reactivos se rompen, los átomos se reorganizan y se forman nuevos enlaces entre los átomos para fabricar los productos. Los alumnos también podrán explicar que en una reacción química no se crean ni destruyen átomos.

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas. Ten cuidado al encender la vela. Asegúrate de que la cerilla y la vela estén completamente apagadas cuando haya terminado con la demostración.
Materiales para la demostración
- Vela de té ligera u otra vela pequeña estable
- Cerillas
- Frasco de vidrio, lo suficientemente grande como para colocarlo sobre la vela
Materiales para cada alumno
- Recortes de átomos de la hoja de actividades
- Hoja de papel de color o papel de construcción
- Lápices de colores
- Tijeras
- Cinta o pegamento
Descarga todos los recursos de la Lección 6.1
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 6.1: ¿Qué es una reacción química?"
Instrucciones
1 Involúcrate
Paso 1
Revisa lo que sucede durante un cambio físico y presenta la idea de cambio químico.
Diles a los alumnos que en capítulos anteriores han estudiado diferentes aspectos de un cambio físico. Cuando los átomos y las moléculas se aceleran o desaceleran, eso es un cambio físico. Cuando cambian de estado, de líquido a sólido o de gas a líquido, se trata de un cambio físico. Cuando una sustancia se disuelve con agua o algún otro disolvente, no se ha formado realmente una sustancia nueva. Los iones o moléculas aún pueden volver a juntarse para formar la sustancia original.
Informa a los alumnos que en este capítulo explorarán lo que sucede durante un cambio químico. En un cambio químico, los átomos de los reactivos se reorganizan y se unen de forma diferente para formar uno o más productos nuevos con características diferentes a las de los reactivos. Cuando se forma una nueva sustancia, el cambio se denomina cambio químico.
Paso 2
Como demostración, enciende una vela y explica qué está ocurriendo utilizando los términos reactivos, productos y reacción química.
Explica que en la mayoría de las reacciones químicas, dos o más sustancias, denominadas reactivos, interactúan para crear sustancias diferentes denominadas productos. Diles a los alumnos que quemar una vela es un ejemplo de una reacción química.
Procedimiento
- Enciende con cuidado una vela de té ligera u otra vela pequeña.
- Mantén la vela encendida mientras haces las siguientes preguntas a los alumnos. Apagarás la vela en la segunda parte de la demostración.
Resultados esperados
La mecha se encenderá y la llama se mantendrá encendida por la reacción química.
La siguiente pregunta no es fácil y no se espera que los alumnos conozcan la respuesta en este momento. Sin embargo, pensar en una vela que está encendida en términos de reacción química es un buen punto de partida para desarrollar lo que significa cuando las sustancias reaccionan químicamente.
Pregunta a los alumnos:
- ¿Cuáles creen que son los reactivos en esta reacción química?
La cera y el oxígeno del aire son los reactivos.
Los alumnos a menudo dicen que la cuerda o la mecha son los elementos que se encienden. Es cierto que el hilo de la mecha se quema, pero es la cera del hilo y no tanto el propio hilo la que se enciende y mantiene la llama de la vela encendida. Explica que las moléculas que componen la cera se combinan con el oxígeno del aire para fabricar los productos dióxido de carbono y vapor de agua.
Señala a los alumnos que esta es una de las principales características de una reacción química:
En una reacción química, los átomos de los reactivos se combinan de formas nuevas y diferentes para formar las moléculas de los productos.
Es posible que los alumnos se sorprendan de que se pueda producir agua a partir de la combustión. Dado que utilizamos agua para extinguir un incendio, puede parecer extraño que la combustión produzca agua. Es posible que desees informar a los alumnos de que cuando metabolizan o “queman” alimentos en su cuerpo, también producen dióxido de carbono y agua.
Paso 3
Coloca un frasco sobre la vela para ayudar a los alumnos a darse cuenta de que el oxígeno es un reactivo cuando una vela está encendida.
Recuerda a los alumnos que el aire es una mezcla de gases. Explica que cuando algo se quema, reacciona con el oxígeno del aire.
Pide a los alumnos que hagan una predicción:
- ¿Seguirá encendida la vela si ya no se dispone de uno de los reactivos (cera u oxígeno)?
Los alumnos pueden adivinar que la vela no se encenderá porque ambos reactivos son necesarios para que continúe la reacción química.

Procedimiento
- Coloca con cuidado un frasco de vidrio sobre la vela encendida.
Resultados esperados
La llama se apaga.
Pregunta a los alumnos:
- ¿Por qué creen que la llama se apaga cuando ponemos un frasco sobre la vela?
Colocar un frasco sobre la vela limita la cantidad de oxígeno en el aire alrededor de la vela. Sin oxígeno suficiente para reaccionar con la cera, la reacción química no puede tener lugar y la vela no puede arder. - Cuando una vela está encendida durante un tiempo, finalmente se hace más y más pequeña. ¿Dónde va la cera de vela?
Cuando una vela se enciende, la cera de la vela parece “desaparecer”. No desaparece realmente: reacciona químicamente y los nuevos productos se incorporan al aire.
Nota: Algunos alumnos curiosos pueden preguntar de qué está hecha la llama. Esta es una excelente pregunta que no tiene una respuesta trivial. La llama es vapor de cera quemada. La luz de la llama se da a partir de un proceso llamado quimioluminiscencia. La energía liberada en la reacción química hace que los electrones de diferentes moléculas pasen a un estado energético superior. Cuando los electrones vuelven a bajar, se libera energía en forma de luz.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 6.1 Hoja de actividades PDF | DOCX | Google Doc
- Lección 6.1 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Observa la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explica
Paso 4
Presenta la ecuación química para la combustión del metano y explica que los átomos se reorganizan para convertirse en moléculas diferentes.
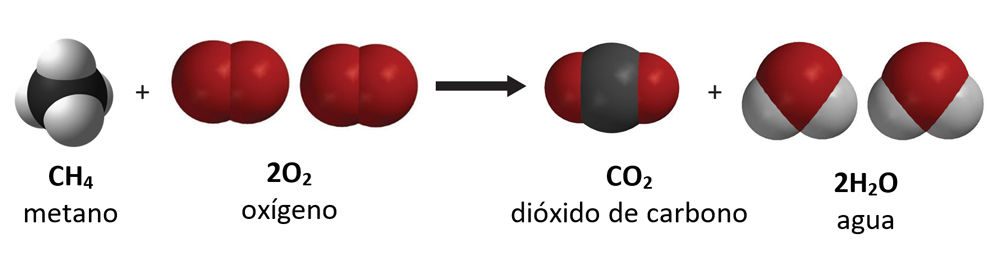
Explica a los alumnos que la cera está formada por moléculas largas denominadas parafina y que la parafina está formada solamente por átomos de carbono y de hidrógeno enlazados. Las moléculas hechas solo de carbono e hidrógeno se denominan hidrocarburos. Informa a los alumnos que usarás el hidrocarburo más sencillo (el metano) como modelo para mostrar cómo se quema la cera o cualquier otro hidrocarburo.
Proyecta la imagen El metano y el oxígeno reaccionan.
Muestra a los alumnos que hay metano y oxígeno del lado izquierdo de la ecuación química y dióxido de carbono y agua del lado derecho. Explica que las moléculas del lado izquierdo son los reactivos y las del lado derecho son los productos. Cuando la vela estaba encendida, la parafina reaccionó con oxígeno en el aire para producir dióxido de carbono y agua, de forma similar a la reacción química entre el metano y el oxígeno.
Explica a los alumnos que la fórmula química del metano es CH4. Esto significa que el metano está compuesto por un átomo de carbono y cuatro átomos de hidrógeno.
Muestra a los alumnos que el otro reactivo es dos moléculas de gas de oxígeno. Señala que cada molécula de gas de oxígeno está compuesta por dos átomos de oxígeno unidos. Puede ser confuso para los alumnos que el átomo de oxígeno y la molécula de oxígeno se denominen ambos oxígeno. Hazles saber a los alumnos que cuando hablamos del oxígeno en el aire, siempre se trata de la molécula de oxígeno, que son dos átomos de oxígeno unidos, u O2.
Pregunta a los alumnos:
- ¿De dónde provienen los átomos que producen el dióxido de carbono y el agua del lado derecho de la ecuación?
Los átomos de los productos provienen de los átomos de los reactivos. En una reacción química, se rompen los enlaces entre los átomos de los reactivos y los átomos se reorganizan y forman nuevos enlaces para hacer los productos.
Nota: Deja esta ecuación proyectada a lo largo de la actividad en la sección Explora de esta lección. Los alumnos tendrán que referirse a ella a medida que modelan la reacción química.
4 Explora
Paso 5
Pide a los alumnos que hagan un modelo que muestre que en una reacción química los átomos de los reactivos se reorganizan para formar los productos.
Pregunta para investigar
En una reacción química, ¿de dónde provienen los átomos de los productos?
Materiales para cada alumno
- Recortes del modelo de un átomo (carbono, oxígeno e hidrógeno)
- Hoja de papel de color o papel de construcción
- Lápices de colores
- Tijeras
- Cinta o pegamento
Procedimiento
Preparar los átomos
- Colorea los átomos de carbono de negro, los átomos de oxígeno de rojo y deja los átomos de hidrógeno en blanco.
- Utiliza tijeras para recortar los átomos con cuidado.
Construir los reactivos
- En una hoja de papel, coloca los átomos juntos para crear las moléculas de los reactivos en el lado izquierdo de la ecuación química para la combustión del metano.
- Escribe la fórmula química debajo de cada molécula de los reactivos. Dibuje también un signo “+” entre los reactivos.
Una vez que estés seguro de que los alumnos han creado y escrito la fórmula para las moléculas de los reactivos, diles que reorganizarán los átomos de los reactivos para formar los productos.
Construir los productos
- Dibuja una flecha después de la segunda molécula de oxígeno para mostrar que se está produciendo una reacción química.
- Reorganiza los átomos de los reactivos para que las moléculas de los productos se produzcan del lado derecho de la flecha.
- Escribe la fórmula química debajo de cada molécula de los productos. Dibuja también un signo “+” entre los productos.
Diles a los alumnos que, en una reacción química, los átomos de los reactivos se separan, reorganizan y crean nuevos enlaces para formar los productos.
Representar la ecuación química
- Pide a los alumnos que utilicen el resto de sus átomos para volver a producir los reactivos y representar la reacción química como una ecuación química completa.
- Pega con pegamento o cinta adhesiva los átomos al papel para hacer una ecuación química más permanente de la combustión del metano.
5 Explica
Paso 6
Ayuda a los alumnos a contar la cantidad de átomos a cada lado de la ecuación.
Proyecta la animación Combustión del metano.
Muestra a los alumnos que los átomos de metano y oxígeno deben separarse como en sus modelos. Señala también que los átomos se organizan de forma diferente y se unen para formar nuevos productos. Esto también es como en su modelo. Asegúrate de que los alumnos se den cuenta de que los átomos de los productos solo provienen de los reactivos. No hay otros átomos disponibles. No se crean nuevos átomos y no se destruye ningún átomo.
Nota: Explica a los alumnos que las reacciones químicas son más complicadas que el modelo simplificado que se muestra en la animación. La animación muestra que los enlaces entre los átomos de los reactivos se rompen y que los átomos se reorganizan y forman nuevos enlaces para hacer los productos.
En realidad, los reactivos deben colisionar e interactuar entre sí para que sus enlaces se rompan y reorganicen. Además, la animación muestra todos los átomos de los reactivos que se separan y reorganizan para formar los productos. Sin embargo, en muchas reacciones químicas, solo se rompen algunos enlaces y los grupos de átomos permanecen juntos a medida que los reactivos forman los productos.
Lee más sobre la combustión del metano en Información contextual para el maestro.
- Lección 6.1 Información contextual para el maestro PDF
Orienta a los alumnos mientras responden juntos la siguiente pregunta:
- ¿Cuántos átomos de carbono, hidrógeno y oxígeno hay en los reactivos en comparación con la cantidad de átomos de carbono, hidrógeno y oxígeno que hay en los productos?
Muestra a los alumnos cómo usar el número grande (coeficiente) delante de la molécula y el número pequeño después de un átomo de la molécula (subíndice) para contar los átomos a ambos lados de la ecuación. Explica a los alumnos que el subíndice indica cuántos de un determinado tipo de átomo hay en una molécula. El coeficiente indica cuántas moléculas hay de un tipo concreto. Por lo tanto, si hay un coeficiente delante de la molécula y un subíndice después de un átomo, se debe multiplicar el coeficiente por el subíndice para obtener la cantidad de átomos.
Por ejemplo, en los productos de la reacción química hay 2H2O. El coeficiente significa que hay dos moléculas de agua. El subíndice significa que cada molécula de agua tiene dos átomos de hidrógeno. Dado que cada molécula de agua tiene 2 átomos de hidrógeno y hay dos moléculas de agua, debe haber 2 × 2 = 4 átomos de hidrógeno.
| Átomos | Lado de los reactivos | Lado del producto |
Carbono | 1 | 1 |
Hidrógeno | 4 | 4 |
Oxígeno | 4 | 4 |
Nota: Los coeficientes indican las proporciones de las cantidades de moléculas en una reacción química. No es el número real como, por ejemplo, dos moléculas de oxígeno y una molécula de metano, ya que normalmente hay miles de millones de moléculas que reaccionan. El coeficiente muestra que hay el doble de moléculas de oxígeno que moléculas de metano en la reacción. Sería correcto decir que en esta reacción hay dos moléculas de oxígeno por cada molécula de metano.
Paso 7
Explica que en una reacción química, la masa se conserva.
Pregunta a los alumnos:
- ¿Se crean o destruyen átomos en una reacción química?
No. - ¿Cómo lo sabes?
Hay el mismo número de cada tipo de átomo tanto en el lado de los reactivos como en el del producto de la ecuación química que exploramos. - En un cambio físico, como el cambio de estado de sólido a líquido, la sustancia misma no cambia realmente. ¿En qué se diferencia un cambio químico de un cambio físico?
En un cambio químico, las moléculas de los reactivos interactúan para formar nuevas sustancias. En un cambio físico, como un cambio de estado o una disolución, no se forma ninguna sustancia nueva.
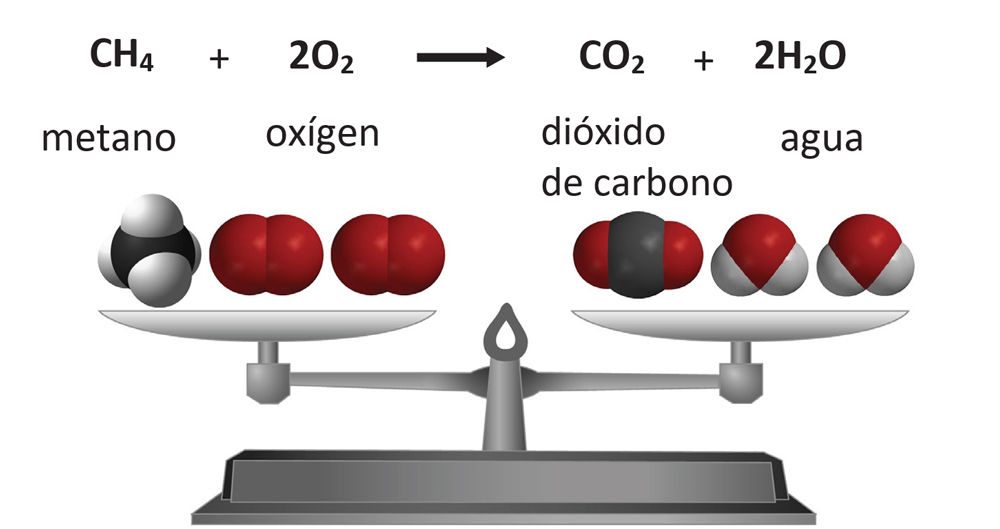
Explica que otra forma de decir que no se crean ni destruyen átomos en una reacción química es decir: “La masa se conserva."
Proyecta la imagen Ecuación equilibrada.
Explica que el equilibrio muestra que la masa de metano y oxígeno de un lado es exactamente igual a la masa de dióxido de carbono y agua del otro. Cuando se escribe la ecuación de una reacción química, esta está “equilibrada” y muestra que los átomos de los reactivos terminan en los productos y que no se crean nuevos átomos y no se destruyen átomos.
6 Amplía
Paso 8
Presenta otras dos reacciones de combustión y pide a los alumnos que comprueben si están equilibradas o no.
Diles a los alumnos que, además de la cera y el metano, algunos otros hidrocarburos comunes son el propano (el combustible de las parrillas de gas para exteriores) y el butano (el combustible de los encendedores desechables). Pide a los alumnos que cuenten la cantidad de átomos de carbono, hidrógeno y oxígeno en los reactivos y los productos de cada ecuación para ver si la ecuación está equilibrada. Deben anotar la cantidad de cada tipo de átomo en la tabla en su hoja de actividades.

metano

propano

butano
Encendido de una parrilla a gas al aire libre: combustión del propano
C3H8 + 5O2 → 3CO2 + 4H20
Uso de un encendedor desechable: combustión del butano
2C4H10 + 13O2 → 8CO2 + 10H2O
Después de que los alumnos hayan contado cada tipo de átomo, revisa sus respuestas para asegurarte de que sepan interpretar los subíndices y los coeficientes.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Descargas
Para los estudiantes
- Lección 6.1 Hoja de actividades PDF | DOCX | Google Doc
Para los Maestros
- Lección 6.1 Plan de lección PDF | DOCX | Google Doc
- Lección 6.1 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Recursos para el Capítulo 6
- Capítulo 6 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 6 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda