¿Pueden disolverse los gases en agua?
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- Los gases pueden disolverse en agua.
- La disolución de un gas en agua depende de la interacción entre las moléculas del gas y las moléculas de agua.
- La cantidad de gas que se puede disolver en el agua depende de la temperatura del agua.
- Se puede disolver más gas en agua fría que en agua caliente.
Resumen
Los alumnos observarán el dióxido de carbono (CO2) disuelto en una botella de agua con gas. Ayudarán a diseñar un experimento para comparar la cantidad de CO2 que permanece en el agua con gas fría en comparación con el agua con gas más tibia.
Objetivo
Los alumnos podrán explicar, a nivel molecular, cómo se disuelve un gas en agua. También podrán explicar por qué el gas sale de la solución más rápido en agua caliente que en agua fría.

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas. Diles a los alumnos de que no coman los M&M. Ten cuidado al manipular agua caliente.
Materiales para la demostración
Botella de 1 litro de agua con gas sin abrir, la que también se utilizará en la actividad.
Materiales para cada grupo
- Agua con gas
- 3 vasos de plástico transparente
- 1 M&M
- Limpiador de tuberías
- Agua caliente
- Agua fría
- 2 contenedores plásticos (en los que los vasos puedan caber fácilmente)
Descarga todos los recursos de la Lección 5.8
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 5.8: ¿Pueden disolverse los gases en agua?"
Instrucciones
1 Involúcrate
Paso 1
Muestra a los alumnos las burbujas que aparecen cuando se abre una botella nueva de agua con gas.
Recuerda a los alumnos que han visto que algunos sólidos y líquidos pueden disolverse en agua (Capítulo 5, Lecciones 5 y 7).
Pregunta a los alumnos:
- ¿Creen que los gases se pueden disolver en agua?
La idea de disolver un gas puede parecer extraña para los alumnos, pero esta demostración les ayudará a darse cuenta de que los gases pueden disolverse en agua.
Materiales
Botella sin abrir de agua con gas de 1 litro
Preparación del maestro
Quita la etiqueta de una botella de agua con gas de 1 litro.
Pregunta a los alumnos:
- ¿En qué se diferencia una botella de agua con gas de una botella de agua normal?
Los alumnos probablemente dirán que el agua con gas tiene burbujas. - ¿Ven alguna burbuja en el agua con gas?
Aún no deberían ver nada.

Procedimiento
- Desenrosca la tapa de la botella muy lentamente.
- Espera unos segundos para que los alumnos puedan observar las burbujas.
- Ajusta la tapa de la botella.
Resultados esperados
Cuando se afloja la tapa, aparecerán muchas burbujas por toda la gaseosa y se elevarán por el agua hasta la superficie, donde explotan. Al ajustar la tapa, se formarán menos burbujas.
Pregunta a los alumnos:
- ¿Qué observaron cuando abrí y después cerré la botella de agua con gas?
Las burbujas solo aparecieron al abrir la botella. Ya no se formaron burbujas al apretar la tapa de la botella. - ¿Cuál es el gas que genera estas burbujas?
Dióxido de carbono (CO2) - ¿Dónde estaba el CO2 antes de abrir la botella?
El dióxido de carbono estaba disuelto en el agua.
Paso 2
Explícales a los alumnos que el agua con gas está hecha de gas de dióxido de carbono disuelto en agua.
Diles a los alumnos que, en una fábrica de agua con gas, se añade gas de dióxido de carbono a alta presión al agua fría para fabricarla. La presión hace que se disuelva más gas de lo que se disolvería normalmente.
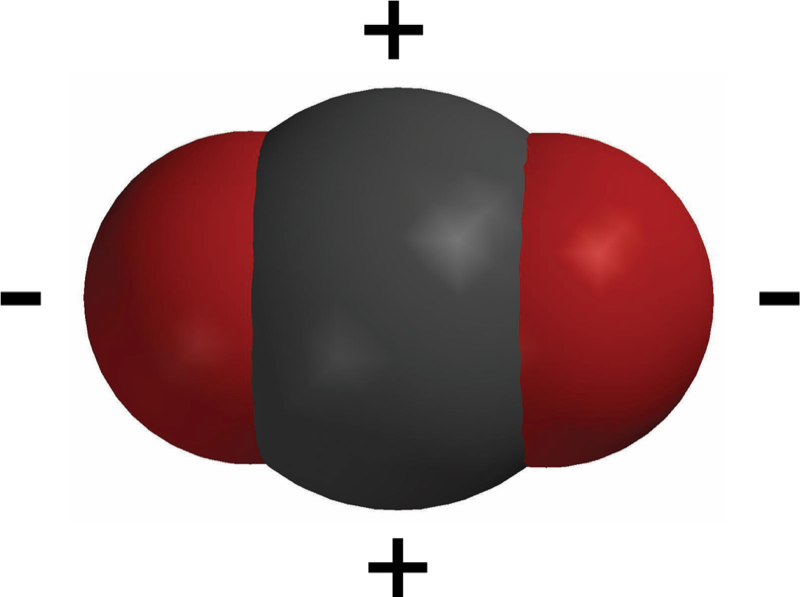
Proyecta la imagen Molécula de CO2.
Señala que una molécula de dióxido de carbono tiene una ligera carga negativa cerca del oxígeno y una ligera carga positiva cerca del carbono. El CO2 es soluble porque las moléculas de agua se ven atraídas a estas áreas polares. El enlace entre el carbono y el oxígeno no es tan polar como el enlace entre el hidrógeno y el oxígeno, pero es lo suficientemente polar como para que el dióxido de carbono se disuelva en agua.
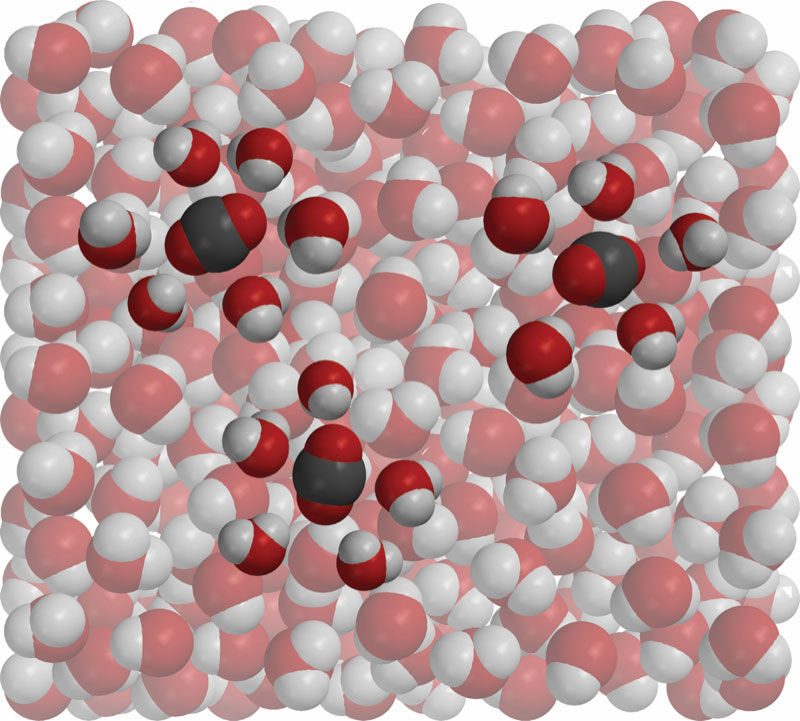
Proyecta la imagen CO2 disuelto en agua.
Explica que, en el agua con gas, las moléculas de dióxido de carbono se mezclan y disuelven a fondo en el agua. Esto es similar a las moléculas de sacarosa, los iones de sodio y cloruro de la sal, o las moléculas del alcohol isopropílico, los que los alumnos disolvieron en agua en actividades anteriores en este capítulo. Señala que, cuando están disueltas, las moléculas de CO2 no son como pequeñas burbujas de gas mezcladas en el agua. En cambio, las moléculas individuales de CO2 están rodeadas de moléculas de agua.
Haz saber a los alumnos que, aunque el CO2 se disuelve, las moléculas no se ven tan fuertemente atraídas por las moléculas de agua como algunas sustancias como la sal o el azúcar. Debido a estas atracciones más débiles, las moléculas de CO2 salen de la solución con relativa facilidad. Por este motivo, las gaseosas pierden presión si se dejan destapadas demasiado tiempo.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 5.8 Hoja de actividades PDF | DOCX | Google Doc
- Lección 5.8 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos describirán el diseño de su experimento, registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Observa la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explora
Paso 3
Pide a los alumnos que añadan objetos al agua con gas para ver si pueden hacer que el gas de dióxido de carbono salga de la solución.
Pregunta a los alumnos:
- Aparte de agitar el agua con gas o dejarla destapada, ¿hay otras formas de hacer que el gas de dióxido de carbono salga del agua con gas?
Diles a los alumnos que pueden colocar objetos en la gaseosa para hacer que el dióxido de carbono salga del agua con gas en forma de burbujas.
Pregunta para investigar
¿Cómo puedes hacer que el gas de dióxido de carbono salga de la solución?
Materiales para cada grupo
- Gaseosa en un vaso de plástico transparente
- 2 vasos de plástico transparente
- M&M
- Limpiador de tuberías
Preparación del maestro
Inmediatamente antes de la actividad, utiliza la botella de agua con gas de la demostración para verter alrededor de 3⁄4 de taza de agua con gas en un vaso de plástico transparente para cada grupo.

Procedimiento
- Divide uniformemente la gaseosa entre los 3 vasos de plástico transparente. Aparta dos de estos vasos para utilizarlos más tarde.
- Coloca un limpiador de tuberías en la gaseosa y observa.
- Coloca un M&M en la gaseosa y observa.
Resultados esperados
Se forman burbujas en el limpiador de tuberías. También se forman burbujas en los M&M, que se elevan a la superficie.
Pregunta a los alumnos:
- ¿De dónde provienen las burbujas de gas que has observado?
Había moléculas de dióxido de carbono disueltas en el agua. - ¿Adónde fue el gas de dióxido de carbono que estaba disuelto en el agua?
Las burbujas de dióxido de carbono ascendieron a la superficie y estallaron, liberando dióxido de carbono en el aire.
Explica que los objetos colocados en la gaseosa tenían áreas con pequeñas salientes donde se depositaban las moléculas de dióxido de carbono. Cuando una cantidad suficiente de moléculas se juntaba en un área determinada, se convertían en una burbuja. Cuando esta burbuja, que es menos densa que el agua que la rodea, se hacía lo suficientemente grande, flotaba en la superficie y estallaba, liberando gas dióxido de carbono en el aire.
Pregunta a los alumnos:
- Cuando bebes gaseosa con un sorbete, es posible que hayas notado que se forman burbujas en el exterior del sorbete. Ahora que has realizado esta actividad, ¿por qué crees que se forman estas burbujas en el sorbete?
Aunque el sorbete parezca liso, también tiene áreas con pequeños bultos, donde se acumulan moléculas de dióxido de carbono. Cuando una cantidad suficiente de ellas se acumulan en una zona, se convierten en una burbuja de gas dióxido de carbono.
Paso 4
Discutan cómo es posible averiguar si la temperatura afecta la rapidez con la que el gas sale del agua con gas.
Pregunta a los alumnos:
- ¿Esperarían que el dióxido de carbono se disuelva mejor en agua caliente o fría? Pista: El agua con gas se conserva en el refrigerador después de abrirse.
Los alumnos descubrirán la respuesta a esta pregunta al realizar la siguiente actividad. - ¿Cómo podrían crear un experimento para averiguar si el dióxido de carbono se disuelve mejor en agua que se caliente o que se enfría?
Los alumnos deben darse cuenta de que necesitarán dos vasos de agua con gas. A continuación, deberán calentar uno y enfriar el otro. Una forma sencilla de calentar y enfriar los vasos es usar un baño de agua caliente o fría como el que se describe en el procedimiento. - Si escapa más gas de dióxido de carbono del agua con gas, ¿habrá más o menos burbujas que explotan en la superficie?
Habrá más burbujas explotando en la superficie. - Si más gas de dióxido de carbono permanece disuelto, ¿habrá más o menos burbujas que explotan en la superficie?
Habrá menos burbujas explotando en la superficie.
Concluye que los alumnos pueden comparar lo rápido que el gas de dióxido de carbono se escapa o permanece en la solución comparando la cantidad de burbujas que ven que suben a la superficie y que estallan. Que más burbujas suban a la superficie y exploten significa que se está escapando más gas de la solución. Que menos burbujas suban a la superficie y exploten significa que queda más gas en la solución.
Paso 5
Pide a los alumnos que calienten y enfríen 2 vasos de agua con gas para averiguar si la temperatura afecta la solubilidad del dióxido de carbono.
Pregunta para investigar
¿Se disuelve mejor el dióxido de carbono en agua que se calentó o en agua que se enfrió?
Materiales para cada grupo
- Agua con gas en 2 vasos de plástico transparente
- Agua caliente (aproximadamente a 50 °C)
- Agua fría (a unos 5 °C)
- 2 contenedores plásticos (en los que los vasos puedan caber fácilmente)
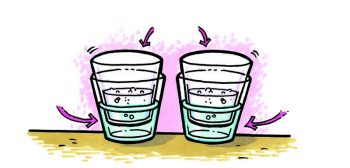
Procedimiento
- Toma los dos vasos de agua con gas que apartaste anteriormente.
- Llena un contenedor plástico hasta aproximadamente 1⁄3 del volumen con agua fría con hielo y otro hasta aproximadamente 1⁄3 del volumen con agua caliente del grifo.
- Coloca cada uno de los vasos de agua con gas en el agua fría y el agua caliente, tal como se muestra.
- Observa la superficie de la gaseosa en cada vaso de agua con gas.
Resultados esperados
Se forman más burbujas y suben a la superficie en el agua con gas que se coloca en agua caliente.
Paso 6
Analiza las observaciones de los alumnos.
Los alumnos deben darse cuenta de que el gas disuelto sale de la solución más rápido cuando el agua con gas está caliente que cuando está fría. Lo contrario también es cierto: El gas disuelto tiende a permanecer disuelto mejor en el agua con gas fría.
Pregunta a los alumnos:
- ¿El dióxido de carbono se mantiene mejor disuelto en agua caliente o en agua fría?
El dióxido de carbono se mantiene mejor disuelto en agua fría. - ¿Cómo lo saben?
Escapa más gas del agua con gas colocada en agua caliente. - Basándote en lo que has observado en este experimento, ¿por qué crees que la gente guarda el agua con gas en el refrigerador después de abrir la botella?
Dado que escapa una menor cantidad de dióxido de carbono cuando el agua con gas está más fría, mantener el agua con gas en el refrigerador evita que pierda la presión.
4 Explica
Paso 7
Explica por qué el gas de dióxido de carbono se escapa del agua caliente más rápido que del agua fría.
Recuerda a los alumnos que el gas de dióxido de carbono está listo para salir del agua con gas, independientemente de la temperatura del agua. Esto se debe a que las moléculas de gas y las moléculas de agua se atraen un poco entre sí, pero no demasiado. Lo único que tienes que hacer es dejar una botella de agua con gas abierta y el dióxido de carbono saldrá por sí solo, lo que hará que el agua con gas pierda la presión. Calentar el agua con gas aumenta el movimiento de las moléculas de agua y dióxido de carbono, lo que hace que sus vínculos sean menos firmes y que el gas se escape aún más rápido.
Nota: Incluso el agua con gas de la que decimos que tiene “poca presión” contiene un poco de dióxido de carbono porque parte del CO2 del aire se disuelve en el agua.
Paso 8
Ayuda a los alumnos a relacionar sus observaciones con el gráfico de la solubilidad del dióxido de carbono en agua.
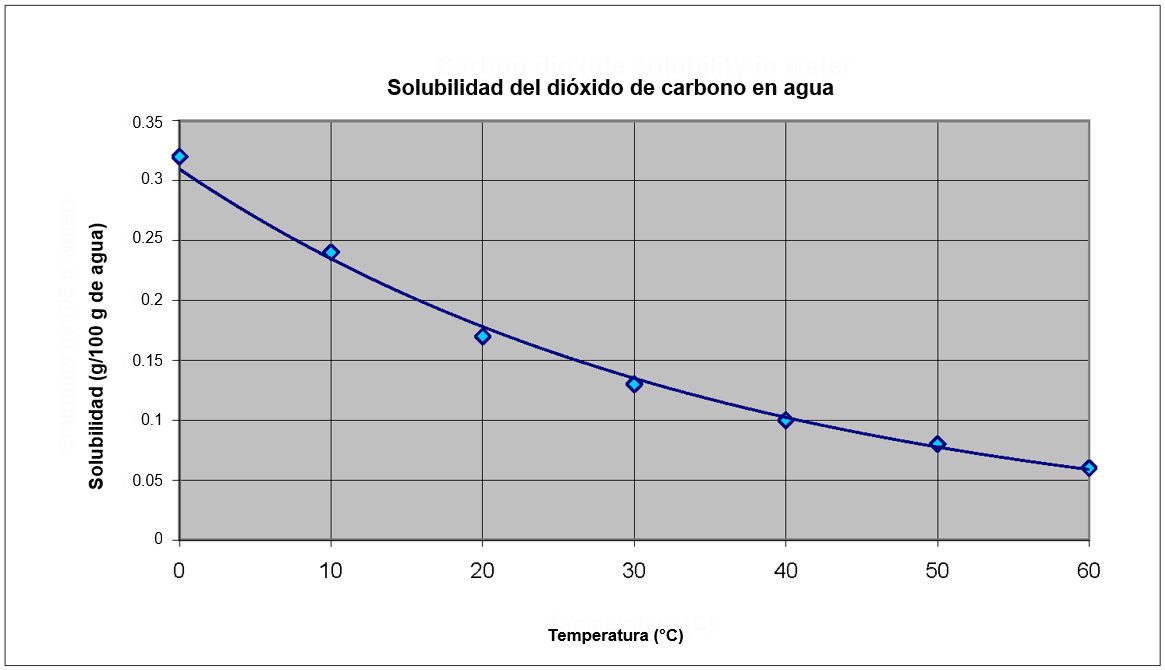
Proyecta la imagen Gráfico de solubilidad del CO2.
Observa el gráfico para ver cómo cambia la concentración de dióxido de carbono en el agua con la temperatura.
Pregunta a los alumnos:
- A medida que aumenta la temperatura, ¿el dióxido de carbono se vuelve más o menos soluble en agua?
El dióxido de carbono se vuelve menos soluble a medida que aumenta la temperatura del agua. - ¿Este gráfico coincide o no con tus observaciones? Explica.
Este gráfico coincide con las observaciones de los alumnos en la actividad. Cuando el agua con gas se calentó, más CO2 abandonó la solución. Dado que salió más gas, se disolvió menos en el agua más caliente. - ¿Qué te dicen los gráficos sobre la solubilidad del dióxido de carbono en comparación con la sacarosa, a medida que aumenta la temperatura?
La curva que muestra la solubilidad del dióxido de carbono disminuye a medida que aumenta la temperatura del agua, mientras que la curva que muestra la solubilidad de la sacarosa aumenta a medida que aumenta la temperatura del agua. Más sacarosa puede disolverse en agua caliente que en agua fría. Pero, en el caso del dióxido de carbono, se puede disolver más en agua fría que en agua caliente.
5 Amplía
Paso 9
Relaciona las experiencias de los alumnos en relación a la solubilidad del dióxido de carbono y la solubilidad del oxígeno.
Diles a los alumnos que hay otro ejemplo común de un gas disuelto en agua. El agua en la que viven los peces y otras criaturas acuáticas tiene gas oxígeno disuelto. Estas criaturas utilizan sus branquias para extraer oxígeno del agua para sobrevivir. Al igual que la solubilidad del dióxido de carbono en agua, la solubilidad del oxígeno disminuye a medida que aumenta la temperatura.
Pregunta a los alumnos:
- Durante los largos veranos calurosos, puedes notar que los peces suben a la superficie del estanque para tomar aire. ¿Por qué crees que los peces salen a la superficie de esta forma, en lugar de respirar el oxígeno disuelto en el agua, como lo hacen normalmente?
Al igual que el dióxido de carbono, la concentración de oxígeno disuelto también se ve afectada por la temperatura. El agua fría es capaz de contener más oxígeno disuelto que el agua caliente. En invierno y a principios de la primavera, cuando la temperatura del agua es baja, la concentración de oxígeno disuelto es alta. En verano y a principios del otoño, cuando la temperatura del agua es alta, la concentración de oxígeno disuelto es baja. - Las centrales energéticas a carbón calientan el agua para hacer girar las turbinas y producir electricidad. Después de usar el agua, se la enfría y devuelve al río o al lago del que provino. ¿Por qué es importante enfriar el agua antes de devolverla al río?
Los gases disueltos, como el oxígeno para los peces y el dióxido de carbono para las plantas acuáticas, se escaparían si el agua devuelta estuviera caliente. El agua fría ayuda a mantener los gases disueltos, lo que es necesario para los peces, otras criaturas acuáticas y plantas submarinas.
Paso 10
Pide a los alumnos que observen y expliquen lo que sucede cuando se introducen caramelos Mentos en una botella de Coca Cola dietética.
Pregunta a los alumnos:
- ¿Alguien ha visto alguna vez la demostración de la Coca Cola dietética y los caramelos Mentos?
Si los alumnos la han visto, pídeles que describan la actividad. Se introduce un paquete completo de caramelos Mentos en una botella de 2 litros de bebida con gas, habitualmente Coca Cola dietética. La gaseosa sale de la botella con mucha fuerza y se eleva por el aire.
Proyecta el video Demostración de caramelos Mentos y Coca Cola dietética.
Si estás dispuesto a hacer esta demostración, debes realizarla al aire libre. Puedes encontrar las instrucciones en http://crazysciencedemos.com.
Recuerda a los alumnos que el limpiador de tuberías y el M&M que añadieron al agua con gas hicieron que el CO2 se escapase de la solución. Los caramelos Mentos y la Coca Cola dietética funcionan de la misma manera. A nivel microscópico, la superficie del caramelo es rugosa, con muchos bultos y huecos diminutos. Cuando se añade el caramelo a la gaseosa, las moléculas de dióxido de carbono se adhieren a estos pequeños puntos llamados puntos de nucleación. En estas áreas se acumulan más moléculas de dióxido de carbono, que forman burbujas. Las burbujas de dióxido de carbono se forman rápidamente y crecen en todas direcciones, pero solo pueden escapar de la parte superior de la botella. Debido a que muchas burbujas se forman y suben a la superficie a la vez, traen consigo una gran cantidad de la gaseosa a medida que salen de ella, lo que crea una “fuente” de gaseosa.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Descargas
Para los estudiantes
- Lección 5.8 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 5.8 Plan de lección PDF | DOCX | Google Doc
- Lección 5.8 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Recursos para el Capítulo 5
- Capítulo 5 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 5 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda