Tensión superficial
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- La atracción de las moléculas en la superficie de un líquido se denomina tensión superficial.
- La polaridad de las moléculas de agua puede ayudar a explicar por qué el agua tiene una fuerte tensión superficial.
Resumen
Los alumnos observarán varios fenómenos relacionados con la polaridad de las moléculas de agua. Observarán una demostración de un clip de papel cuando se coloca sobre la superficie del agua. Los alumnos colocarán gotas de agua en un tubo de ensayo ya lleno y sobre la superficie de una moneda. Compararán el comportamiento del agua con el alcohol isopropílico líquido, que es menos polar, y verán cómo el detergente afecta la tensión superficial del agua. Los alumnos relacionarán estas observaciones con una explicación de la tensión superficial a nivel molecular.
Objetivo
Los alumnos podrán explicar, a nivel molecular, los efectos de la polaridad en la tensión superficial del agua.

Seguridad
- Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas. El alcohol isopropílico es inflamable. Mantenlo alejado de cualquier llama o fuente de chispa. Lee y sigue todas las advertencias de la etiqueta. Usa el producto en una sala bien ventilada.
- Se debe dejar que el alcohol isopropílico con el que se humedecieron las toallas de papel se evapore. Luego, podrás tirar la toalla de papel seca a la basura.
- Se pueden desechar pequeñas cantidades de alcohol isopropílico en el desagüe o de acuerdo con la normativa local.
- Pide a los alumnos que se laven las manos después de la actividad.
Materiales para la demostración
- 1 vaso de plástico transparente
- Agua
- 1 clip de papel de tamaño estándar
- 1 clip de papel grande
Materiales para cada grupo
- Agua
- Alcohol isopropílico (al 70 % o más)
- Detergente de lavavajillas en un vaso
- Tubo de ensayo
- 2 monedas
- 2 goteros
- 2 palillos de dientes
- 2 toallas de papel
Descarga todos los recursos de la Lección 5.2
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 5.2: Tensión superficial."
Instrucciones
1 Involúcrate
Paso 1
Haz una demostración para hacer visible la tensión superficial del agua.
Realiza la siguiente demostración para los alumnos o muéstrales el vídeo Tensión superficial del agua.
Materiales
- 1 vaso de plástico transparente
- Agua
- 1 clip de papel de tamaño estándar
- 1 clip de papel grande

Preparación del maestro
Abre el clip de papel grande hasta que quede recto. A continuación, dóblalo en forma de “U”. Dobla un poco la parte inferior de cada extremo, como se muestra. Este será tu dispositivo para recoger y colocar el clip de papel más pequeño sobre la superficie del agua. Funciona como unas pinzas, pero al revés: deja que se separe para recoger el clip de papel y aprétalo para soltarlo.

Procedimiento
- Coloca el agua en un vaso hasta que esté lleno hasta aproximadamente 3/4 de su volumen.
- Utiliza tu dispositivo para recoger un clip de papel. Hazlo apretando los extremos del dispositivo un poco y colocándos dentro del clip de papel. A continuación, deja que los extremos se separen para que la tensión de los extremos empuje contra el interior del clip de papel para mantenerlo en su sitio.
- Haz descender con mucho cuidado el clip de papel hasta que quede plano sobre la superficie del agua. Aprieta lentamente el dispositivo para soltar el clip de papel.
Resultados esperados
El clip de papel debe descansar sobre la superficie del agua. Esto posiblemente necesite varios intentos.
Pregunta a los alumnos:
- ¿Por qué creen que un clip de papel, que es más denso que el agua, puede permanecer sobre la superficie del agua?
Recuerda a los alumnos que los clips de papel son más densos que el agua y normalmente se hundirían. Ayuda a los alumnos a darse cuenta de que el clip de papel de la demostración se mantuvo sobre la superficie del agua debido a algo que tiene que ver con las moléculas de agua en la superficie del agua, lo que se denomina tensión superficial.
Paso 2
Pide a los alumnos que relacionen sus observaciones de la demostración con un bicho de agua situado sobre la superficie del agua.
Proyecta la imagen Bicho de agua y molécula.
Señala cómo la superficie del agua parece doblarse, pero no se rompe bajo las patas del bicho de agua. Diles a los alumnos que lo que ven es otro ejemplo de la tensión superficial del agua.
Pregunta a los alumnos:
- ¿Por qué creen que el agua tiene una tensión superficial tan fuerte?
Anima a los alumnos a pensar acerca de lo que ya saben sobre la fuerte atracción entre las moléculas de agua. Los alumnos deben recordar que las moléculas de agua se atraen mucho entre sí y esta atracción es la base de la tensión superficial. Esto se explicará con más detalle más adelante en esta lección.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 5.2 Hoja de actividades PDF | DOCX | Google Doc
- Lección 5.2 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán junto con la clase, en grupos o individualmente, según tus instrucciones. Observa la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explora
Paso 3
Pide a los alumnos que añadan con cuidado una sola gota de agua a un tubo de ensayo lleno.
Diles que hay otro fenómeno causado por la tensión superficial del agua. Es la capacidad del agua de llenar más allá de la parte superior de un recipiente.
Pregunta para investigar
¿Cuánta agua puedes añadir a un tubo de ensayo lleno?
Materiales para cada grupo
- Agua
- Gotero
- Tubo de ensayo
- Moneda
- 2 toallas de papel

Procedimiento
- Vierte agua en un tubo de ensayo de modo que el agua quede muy cerca de la parte superior del tubo de ensayo.
- Sujeta el tubo de ensayo al nivel de los ojos y utiliza un gotero para añadir cuidadosamente gotas de agua, de a una por vez, en el tubo de ensayo.
- Observa el agua de la parte superior del tubo de ensayo mientras añades las gotas. Continúa añadiendo gotas hasta que el agua se derrame.
- Coloca una moneda sobre una toalla de papel.
- Mirando desde un costado, añade una sola gota de agua a la moneda. Continúa añadiendo gotas hasta que el agua se derrame.
Resultados esperados
Mirando desde un costado, los alumnos verán que el agua forma una cúpula en la parte superior del tubo de ensayo y sobre la moneda.
Pregunta a los alumnos:
- ¿Cómo se veía el agua al añadirla a la parte superior del tubo de ensayo y sobre la moneda?
El agua produce una “cúpula” o un “montículo” de agua por encima de la parte superior del tubo de ensayo y de una moneda.
4 Explica
Paso 4
Explica cómo las atracciones entre moléculas de agua proporcionan al agua su fuerte tensión superficial.
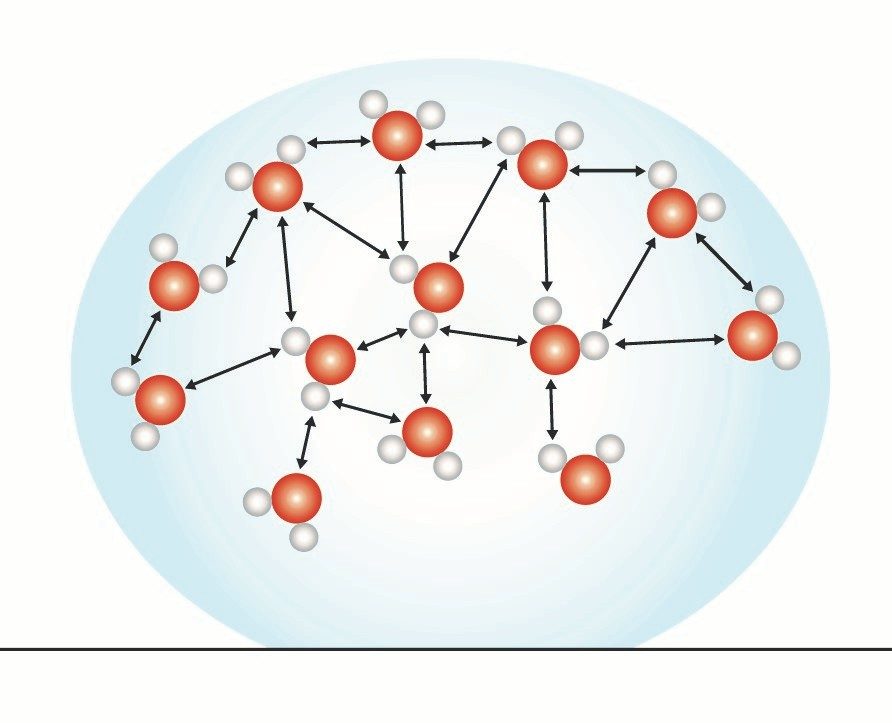
Proyecta la imagen Por qué el agua forma gotas.
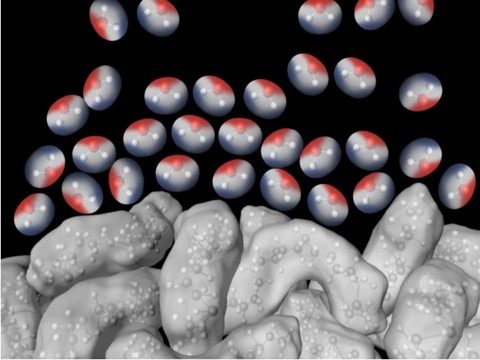
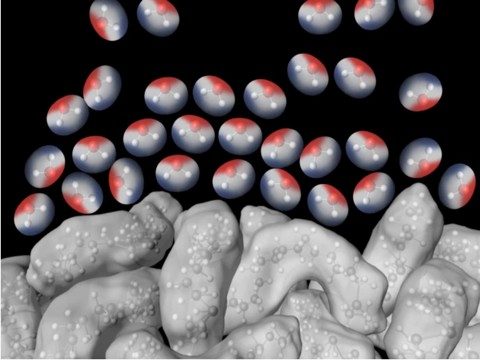
Explica a los alumnos que la tensión superficial del agua está basada en las atracciones entre las moléculas de agua en la superficie y las moléculas de agua en el resto del agua. Una molécula de agua debajo de la superficie siente las atracciones de todas las moléculas que la rodean. Pero las moléculas de la superficie solo sienten las atracciones de las moléculas que están junto a ellas y debajo de ellas.
Estas atracciones hacen que las moléculas de la superficie se junten entre sí y hacia el interior. Esta tracción hacia adentro tiene el efecto de comprimir a las moléculas de la superficie, las que se disponen de manera apretada sobre la superficie del agua. La disposición apretada al nivel de la superficie se denomina tensión superficial.
La tensión hacia adentro de las atracciones de las moléculas da lugar a la superficie más pequeña posible para un volumen de agua, que es una esfera. Por este motivo, el agua forma una gota o cúpula redonda en la parte superior del tubo de ensayo lleno y sobre la superficie de una moneda.
5 Explora
Paso 5
Haz que los alumnos comparen la tensión superficial del agua y el alcohol.
Pregunta a los alumnos:
- ¿Cómo podríamos comparar la tensión superficial del agua y el alcohol?
Los alumnos pueden sugerir colocar una cantidad igual de gotas de cada líquido sobre papel encerado, llenar en exceso un tubo de ensayo o comparar la cantidad de gotas que se pueden añadir a la parte superior de una moneda.
Nota: Aunque existen muchas formas de comparar la tensión superficial del agua y el alcohol, el procedimiento que se escribe a continuación compara cada líquido sobre la superficie de una moneda. Para que esta prueba sea lo más razonable posible, los alumnos deben colocar cada líquido en dos monedas similares que sean tanto “cabezas” como “colas”. También deben asegurarse de añadir gotas individuales de cada líquido despacio y con cuidado.
Pregunta para investigar
¿Cuál tiene una mayor tensión superficial, el agua o el alcohol?
Materiales para cada grupo
- 2 monedas
- 2 goteros
- Agua
- Alcohol isopropílico (al 70 % o más)
- Toalla de papel

Procedimiento
- Coloca dos monedas sobre una toalla de papel.
- Usa un gotero para añadir gotas de agua sobre la superficie de una moneda. Cuenta las gotas hasta que el agua se desborde.
- Usa un gotero para añadir gotas de alcohol sobre la superficie de la otra moneda. Cuenta las gotas hasta que el alcohol se desborde.
Resultados esperados
El agua forma una gota sobre la moneda, mientras el alcohol se extiende plano. Se pueden añadir muchas más gotas de agua a la moneda que gotas de alcohol.
6 Explica
Paso 6
Comenta las observaciones de los alumnos y por qué no pudieron colocar tantas gotas de alcohol sobre una moneda.
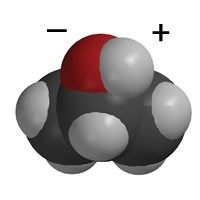
Proyecta la imagen Agua y alcohol.
Repasa que las moléculas de agua sean polares y que estén muy atraídas entre sí. Señala que las moléculas de alcohol son polares solo en una zona, lo que hace que se atraigan ligeramente entre sí. La atracción a otras moléculas de alcohol no es tanta como lo es la del agua a otras moléculas de agua.
Agua y alcohol sobre monedas
Explica que la atracción del agua hace que esta se disponga de manera apretada. Explica que la estructura de las moléculas de alcohol no es tan buena como la del agua para atraerse a sí misma. Las moléculas de alcohol solo tienen 1 enlace O–H y tienen algunos enlaces C–H que son bastante apolares. No hay una atracción tan fuerte entre ellas como entre las moléculas de agua.
La forma de la molécula de agua y su polaridad en la parte superior e inferior proporcionan a las moléculas de agua muchas oportunidades de atracción. Casi en cualquier lugar en el que se encuentran dos moléculas de agua, se pueden atraer entre sí.
Pero el alcohol tiene un tamaño y una forma diferentes, y tiene su parte polar en un extremo. Las moléculas de alcohol pueden encontrarse en zonas en las que no se atraen con tanta fuerza. El agua está más atraída por sí misma que por el metal de la moneda. El alcohol está un poco menos atraído por sí mismo, por lo que se extiende más sobre la moneda.
7 Explora
Paso 7
Pide a los alumnos que añadan detergente al agua sobre una moneda.
Pregunta para investigar
¿Cómo afecta el detergente la tensión superficial del agua?
Materiales
- Detergente de lavavajillas en un vaso
- 2 monedas
- Gotero
- 2 palillos de dientes
- Toalla de papel

Procedimiento
- Coloca 2 monedas limpias y secas sobre una superficie plana como una mesa o un escritorio.
- Usa un gotero para añadir agua a ambas monedas. Añade la misma cantidad de gotas sobre cada moneda, de modo que el agua se acumule en forma de cúpula hasta aproximadamente la misma altura en ambas.
- Toca suavemente el agua de una de las monedas con un palillo de dientes. Observa la superficie del agua mientras la tocas.
- Sumerge el palillo de dientes en detergente líquido y luego toca el agua de la otra moneda con el palillo de dientes.
Nota: Esta actividad tiene mejores resultados si la cúpula de agua sobre las monedas es bastante alta.
Resultados esperados
Si tocas el agua con el palillo de dientes, la superficie del agua se empuja hacia abajo y se dobla. Si tocas el agua con el palillo de dientes y el detergente, el agua se colapsa y se derrama.
8 Explica
Paso 8
Explica cómo interfiere el detergente en la tensión superficial del agua.
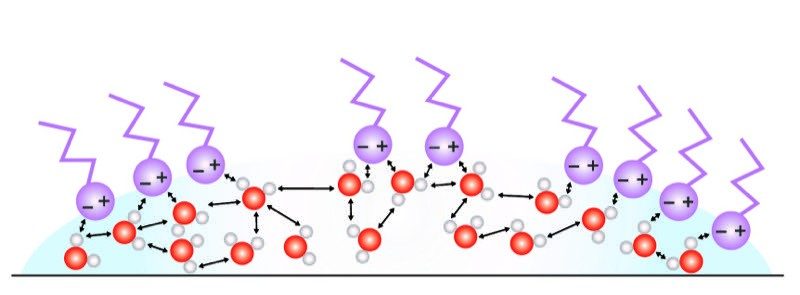
Proyecta la imagen Agua y detergente.
Explica que el detergente está hecho de moléculas que tienen un extremo cargado y un extremo no cargado más largo. Las moléculas de detergente se distribuyen sobre la superficie del agua con el extremo cargado en el agua y el extremo no cargado sobresaliendo. Las moléculas de agua de la superficie se ven atraídas por el extremo cargado de las moléculas de detergente. A medida que las moléculas de agua superficial se atraen hacia afuera, esto actúa contra su atracción hacia adentro, la que estaba creando la tensión superficial. Esto reduce la tensión superficial y el agua no mantiene su forma redonda y, por tanto, se derrama.
9 Amplía
Paso 9
Explica cómo la polaridad del material sobre el que se coloca el agua afecta la absorción o formación de gotas de agua.
Pregunta a los alumnos:
- Si el agua se absorbe en una toalla de papel, pero no se absorbe en el papel encerado, ¿qué dice eso sobre la polaridad del papel y la polaridad del papel encerado?
Las moléculas que componen el papel son probablemente polares, y las moléculas que componen la cera probablemente apolares.
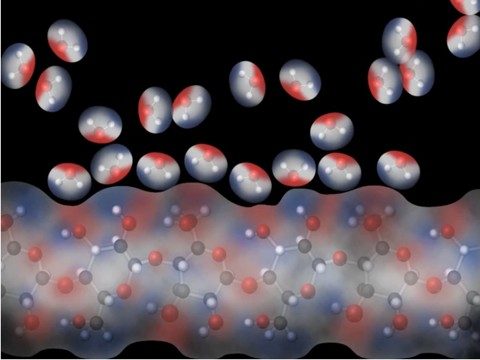
Proyecta la animación Agua en una toalla de papel.
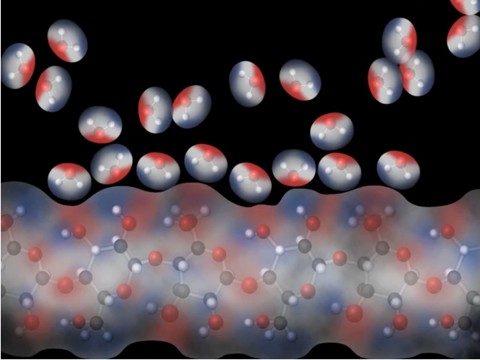
Explica que la toalla de papel y otro papel están hechos de celulosa. La celulosa se fabrica a partir de moléculas repetidas de glucosa que se unen entre sí. La molécula de glucosa tiene muchos enlaces O–H, que son polares. Las moléculas de agua polares son atraídas a la celulosa polar y se adhieren a ella.
Proyecta la animación Agua en papel encerado.
Diles a los alumnos que la cera está hecha de parafina, que repite enlaces de carbono-hidrógeno. El enlace C–H no es muy polar, por lo que el agua está más atraída hacia sí misma que hacia la cera. Esto hace que el agua se acumule en el papel encerado.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Descargas
Para los estudiantes
- Lección 5.2 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 5.2 Plan de lección PDF | DOCX | Google Doc
- Lección 5.2 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Recursos para el Capítulo 5
- Capítulo 5 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 5 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda