¿Por qué el agua disuelve la sal?
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- La polaridad de las moléculas de agua permite que el agua disuelva muchas sustancias con enlaces iónicos.
- La sal (cloruro de sodio) se elabora a partir de iones de sodio positivos unidos a iones de cloruro negativos.
- El agua es capaz de disolver la sal porque la parte positiva de las moléculas de agua atrae a los iones de cloruro negativos y la parte negativa de las moléculas de agua atrae a los iones de sodio positivos.
- La cantidad de una sustancia que puede disolverse en un líquido (a una temperatura concreta) se denomina solubilidad de la sustancia.
- La sustancia que se disuelve se denomina soluto, y la sustancia responsable de la disolución se denomina disolvente.
Resumen
Los alumnos crearán un modelo 2D de un cristal de sal y utilizarán recortes de moléculas de agua para mostrar cómo el agua disuelve la sal. Después de ver una animación del agua disolviendo la sal, los alumnos compararán el modo en que el agua y el alcohol disuelven la sal. Relacionarán sus observaciones con la estructura de la sal, el agua y el alcohol a nivel molecular.
Objetivo
Los alumnos podrán explicar, a nivel molecular, por qué el agua es capaz de disolver la sal. Los alumnos podrán identificar las variables en su experimento. Los alumnos también podrán explicar por qué un líquido menos polar, como el alcohol, no disuelve bien la sal.

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas. El alcohol isopropílico es inflamable. Mantenlo alejado de cualquier llama o fuente de chispa. Lee y sigue todas las advertencias de la etiqueta. El alcohol debe eliminarse de acuerdo con la normativa local. Pide a los alumnos que se laven las manos después de la actividad.
Materiales para cada grupo
- Papel de construcción de cualquier color
- Tijeras
- Cinta o pegamento
- Agua
- Alcohol isopropílico (al 70 % o más)
- Sal
- Balanza
- 2 vasos de plástico transparente
- 2 vasos de plástico pequeños
- Cilindro graduado
Descarga todos los recursos de la Lección 5.3
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 5.3: ¿Por qué el agua disuelve la sal?"
Instrucciones
1 Involúcrate
Paso 1
Crear un modelo de un cristal de sal.
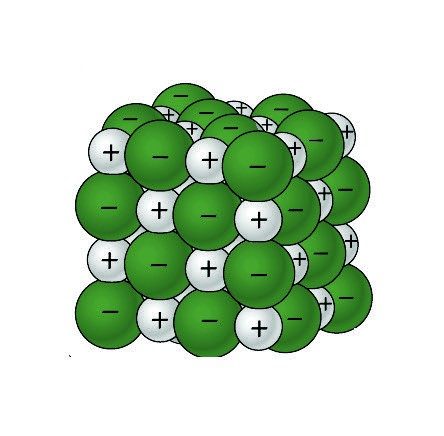
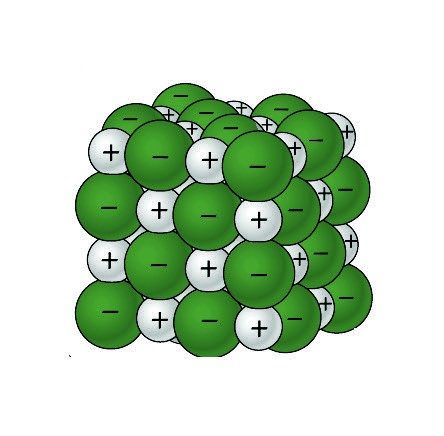
Proyecta la imagen Cristal de cloruro de sodio.
Recuerda a los alumnos que las esferas verdes representan iones de cloruro negativos y las esferas grises representan iones de sodio positivos.
Pregunta a los alumnos:
- ¿Qué ocurre con las moléculas del agua y los iones de la sal que podrían hacer que el agua sea capaz de disolver la sal?
Los extremos polares positivo y negativo de una molécula de agua se atraen a los iones de cloruro negativos y a los iones de sodio positivos de la sal.
Pregunta para investigar
¿Cómo se disuelve la sal en agua?
Materiales
- Hoja de actividades con iones de sodio y cloruro y moléculas de agua
- Papel de construcción de cualquier color
- Tijeras
- Cinta o pegamento
Procedimiento
Crear un modelo de un cristal de sal
- Recorta los iones y las moléculas de agua.
- Coloca los iones sobre un trozo de papel de construcción para representar en 2D un cristal de sal. No fijes estas piezas con cinta adhesiva aún.
Paso 2
Proyecta una imagen y pide a los alumnos que modelen lo que sucede cuando la sal se disuelve en agua.
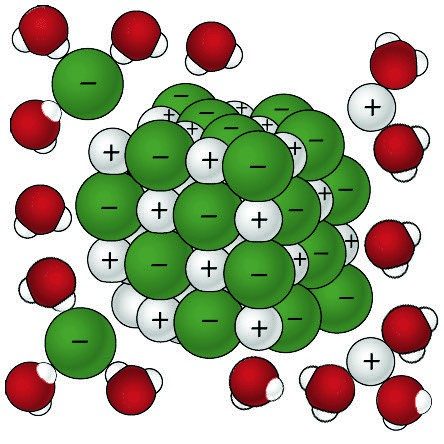
Muestra a los alumnos una serie de cuatro imágenes para ayudar a explicar el proceso de cómo la sal que disuelve el agua.
Proyecta la imagen Cloruro de sodio disolviéndose en agua.
Señala que varias moléculas de agua pueden disponerse cerca de un ión y ayudar a eliminarlo del cristal. Muestra a los alumnos que el área positiva de una molécula de agua se atraerá al ion de cloruro negativo y que el área negativa de una molécula de agua se atraerá al ion de sodio positivo.

Modelar cómo el agua disuelve la sal
- Observa las imágenes que muestran cómo las moléculas de agua disuelven la sal. A continuación, coloca las moléculas de agua alrededor de los iones de sodio y cloruro en la orientación correcta. La parte positiva de las moléculas de agua debe estar cerca del ion de cloruro negativo. La parte negativa de las moléculas de agua debe estar cerca del ion de cloruro positivo.
- Mueve las moléculas de agua y los iones de sodio y cloruro para modelar cómo el agua disuelve la sal.
- Fija con cinta adhesiva las moléculas y los iones al papel para representar cómo el agua disuelve la sal.
Proyecta la animación Cloruro de sodio disolviéndose en agua.
Señala que las moléculas de agua son atraídas a los iones de sodio y cloruro del cristal de sal. Explica que el área positiva de una molécula de agua es atraída a un ion de cloruro negativo. El área negativa de agua de una molécula de agua es atraída a un ion de sodio positivo. La disolución se produce cuando las atracciones entre las moléculas de agua y los iones de sodio y cloruro superan a las atracciones de los iones entre sí. Esto hace que los iones se separen unos de otros y se mezclen bien en el agua.
Diles a los alumnos que la cantidad de una sustancia que puede disolverse en un líquido (a una temperatura determinada) se denomina solubilidad. Señala la similitud entre las palabras disolver y solubilidad. Diles también que la sustancia que se disuelve se llama soluto. La sustancia encargada de la disolución se denomina disolvente.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 5.3 Hoja de actividades PDF | DOCX | Google Doc
- Lección 5.3 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán junto con la clase, en grupos o individualmente, según tus instrucciones. Observa la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explora
Paso 3
Solicita a los alumnos que realicen un experimento para averiguar cuál sería mejor para disolver sal, si el agua o el alcohol isopropílico.
Pide a los alumnos que hagan una predicción:
- Piensa en la polaridad de las moléculas de agua y las moléculas de alcohol. ¿Creen que el alcohol sería igual, mejor o peor que el agua para disolver la sal?
Comenta cómo establecer una prueba para comparar cómo el agua y el alcohol disuelven la sal. Asegúrate de que los alumnos identifiquen variables como:
- Cantidad de agua y alcohol utilizada
- Cantidad de sal añadida a cada líquido
- Temperatura de cada líquido
- Cantidad de agitación
Pregunta para investigar
¿El alcohol es igual, mejor o peor que el agua para disolver la sal?
Materiales para cada grupo
- Agua
- Alcohol isopropílico (al 70 % o más)
- Sal
- Balanza
- 2 vasos de plástico transparente
- 2 vasos de plástico pequeños
- Cilindro graduado

Procedimiento
- En vasos separados, mide dos muestras de sal que pesen 5 gramos cada una.
- Coloca 15 ml de agua y alcohol en vasos separados.
- Al mismo tiempo, añade el agua y el alcohol a las muestras de sal.
- Agita ambos vasos de la misma manera durante unos 20 segundos y comprueba la cantidad de sal disuelta.
- Agita durante otros 20 segundos y comprueba. Agita durante los últimos 20 segundos y comprueba.
- Vierte con cuidado el agua y el alcohol de los vasos, y compara la cantidad de sal no disuelta que queda en cada vaso.
Resultados esperados
Habrá menos cantidad de sal sin disolver en el vaso con el agua que en el de alcohol. Esto significa que se disuelve más sal en agua que en alcohol.
4 Explica
Paso 4
Comenta cómo las diferencias en la polaridad del alcohol y el agua explican por qué el agua disuelve mejor la sal que el alcohol.
Pregunta a los alumnos:
- ¿El alcohol es igual, mejor o peor que el agua para disolver la sal?
El alcohol no disuelve tanto la sal como lo hace el agua. - ¿Cómo lo saben?
Quedó más sal en el vaso con el alcohol. - Piensa en la polaridad del agua y el alcohol para explicar por qué el agua disuelve mejor la sal que el alcohol.
Pide a los alumnos que miren los modelos de moléculas de agua y alcohol en su hoja de actividades.

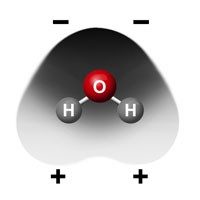
Recuerda a los alumnos que el alcohol isopropílico tiene un átomo de oxígeno unido a un átomo de hidrógeno, por lo que tiene cierta polaridad, pero no tanta como el agua. Dado que el agua es más polar que el alcohol, atrae mejor los iones de sodio positivos y los iones de cloruro negativos que el alcohol. Por eso el agua disuelve más sal que el alcohol. Otra forma de decir esto es que la solubilidad de la sal es mayor en agua que en alcohol.
Obtén más información sobre la polaridad en Información contextual para el maestro.
- Lección 5.3 Información contextual para el maestro PDF
5 Amplía
Paso 5
Haz que los alumnos comparen la solubilidad de dos sustancias iónicas diferentes en agua.
Compara la solubilidad de las sustancias iónicas carbonato de calcio (CaCO3) y carbonato de sodio (Na2CO3) en agua.
Pregunta a los alumnos:
- ¿Cómo podrían comparar la solubilidad del cloruro de calcio y del carbonato de calcio?
Los alumnos deben sugerir medir cantidades iguales de cada sustancia y añadir cantidades iguales de agua a la misma temperatura.
Pregunta para investigar
¿Todas las sustancias iónicas se disuelven en agua?
Materiales para cada grupo
- Carbonato de sodio
- Carbonato de calcio
- Agua
- 2 vasos de plástico transparente
- 2 vasos de plástico pequeños
- Balanza

Procedimiento
- Etiqueta dos vasos de plástico transparente: “Carbonato de sodio” y “Carbonato de calcio”.
- Mide 2 g de cada uno, carbonato de sodio y carbonato de calcio, y colócalos en sus vasos etiquetados.
- Mide 15 ml de agua en cada uno de los dos vasos vacíos.
- Al mismo tiempo, vierte el agua en los vasos de carbonato de sodio y carbonato de calcio.
- Haz girar suavemente ambos vasos.
Resultados esperados
El carbonato de sodio se disolverá, pero el carbonato de calcio no. Explica que no todos los sólidos con enlaces iónicos se disuelven en agua.
Paso 6
Analiza las observaciones de los alumnos.
Pregunta a los alumnos:
- ¿Todas las sustancias iónicas se disuelven en agua? ¿Cómo lo saben?Dado que el carbonato de calcio no se disuelve en agua, los alumnos deben darse cuenta de que no todas las sustancias iónicas se disuelven en agua.
Explica que, a nivel molecular, los iones que componen el carbonato de calcio se atraen con tanta fuerza entre sí que la atracción que ejercen las moléculas de agua no puede separarlos.
Esto es bueno porque el carbonato de calcio es el material del que están hechos los caracoles marinos y los huevos de los pájaros. El fosfato de calcio es otro sólido iónico que no se disuelve en agua. Esto también es bueno porque es el material del que están hechos los huesos y los dientes.
El carbonato de sodio se separa completamente en iones que se incorporan a través del agua, formando una solución. Los iones de sodio y carbonato no se asientan en el fondo y no se los puede filtrar del agua.
Pero el carbonato de calcio no se descompone en sus iones. En cambio, se mezcla con el agua. Si se le da tiempo suficiente, el carbonato de calcio se asienta en el fondo o se lo puede filtrar del agua. El carbonato de sodio disuelto en agua es un buen ejemplo de una solución, y el carbonato de calcio no disuelto es una mezcla, no una solución.
Nota: El ion de carbonato es diferente de los iones de átomos individuales como el sodio (Na+) y el cloruro (Cl–) que los alumnos han visto hasta ahora. El ion de carbonato (CO2-) está compuesto por más de un átomo. Estos tipos de iones, llamados iones poliatómicos, están compuestos por un grupo de átomos con enlaces covalentes que actúan como una unidad. Normalmente, ganan o pierden uno o más electrones y actúan como iones. Otro ion poliatómico común es el ion de sulfato (SO2-). Este ion forma parte de la sal de Epsom como sulfato de magnesio (MgSO4) y de muchos fertilizantes como el sulfato de potasio (K2SO4). Puedes decidir si deseas presentar a los alumnos estos dos iones poliatómicos comunes.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Descargas
Para los estudiantes
- Lección 5.3 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 5.3 Plan de lección PDF | DOCX | Google Doc
- Lección 5.3 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
- Lección 5.3 Información contextual para el maestro PDF
Recursos para el Capítulo 5
- Capítulo 5 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 5 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda