Usar la disolución para identificar un elemento desconocido
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- Diferentes sustancias se fabrican a partir de diferentes átomos, iones o moléculas, que interactúan con el agua de diferentes maneras.
- Dado que la disolución depende de la interacción entre el agua y la sustancia que se disuelve, cada sustancia tiene una solubilidad característica.
Resumen
Los alumnos observarán una prueba de solubilidad entre la sal y el azúcar. A continuación, se les presentarán cuatro cristales conocidos y uno desconocido. Basándose en la demostración de solubilidad, la clase diseñará una prueba de solubilidad para descubrir la identidad del elemento desconocido.
Objetivo
Los alumnos podrán identificar y controlar las variables al diseñar una prueba de solubilidad. Los alumnos podrán explicar por qué diferentes sustancias se disuelven en diferente medida en el agua.

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas.
Materiales para las demostraciones
- Balanza en gramos
- Balanza simple
- Cilindro graduado
- Agua
- 4 vasos de plástico transparente
- 2 vasos de plástico pequeños
- Sal
- Azúcar
- Cereales redondos (Kix funciona bien)
- Bolsa plástica con cierre hermético (de un cuarto de galón, para almacenamiento)
Materiales para cada grupo
- Sal (cloruro de sodio)
- Sal de Epsom (sulfato de magnesio)
- MSG (glutamato monosódico)
- Azúcar (sacarosa)
- Sal kosher gruesa (cloruro de sodio)
- Agua
- Papel de construcción negro
- Cinta de enmascarar
- Bolígrafo o marcador permanente
- Lupa
- Balanza en gramos
- 5 vasos de plástico pequeños
- 5 vasos de plástico transparente
- Cilindro graduado
- Toalla de papel
Descarga todos los recursos de la Lección 5.5
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 5.5: Usar la disolución para identificar un elemento desconocido."
Instrucciones
1 Involúcrate
Paso 1
Haz una demostración para mostrar que las diferentes sustancias tienen diferentes solubilidades.
Diles a los alumnos que en esta demostración verterás sal y azúcar en agua para averiguar cuál se disuelve mejor. Para que esta prueba sea razonable, deberás utilizar la misma cantidad (masa) de sal y azúcar, la misma cantidad de agua a la misma temperatura y deberás remover cada una de la misma manera durante el mismo periodo de tiempo.
Pregunta para investigar
¿Qué se disuelve mejor en agua, la sal o el azúcar?
Materiales para la demostración
- Balanza que realiza la medición en gramos
- Cilindro graduado
- Agua
- 2 vasos de plástico transparente
- 2 vasos de plástico pequeños
- Sal
- Azúcar

Preparación del maestro
- Etiqueta 1 vaso de plástico transparente y 1 vaso pequeño con el nombre “Sal”.
- Etiqueta el otro vaso de plástico transparente y el otro vaso pequeño con el nombre “Azúcar”.
- Mide 5 gramos de sal y 5 gramos de azúcar y colócalos en el par de vasos pequeños etiquetados.
- Vierte 5 ml de agua a temperatura ambiente en el par de vasos vacíos más grandes.
Procedimiento
- Al mismo tiempo, vierte la sal y el azúcar en el agua de los vasos correspondientes. Haz girar cada vaso al mismo tiempo y de la misma manera durante unos 20 segundos.
- Camina por la sala para mostrar a los alumnos cuánta sal y azúcar queda en la parte inferior de cada vaso. Si tienes un retroproyector, coloca los vasos en el proyector para que toda la clase pueda comparar lo que queda sin disolver en cada vaso. Pregunta a los alumnos si una sustancia parece disolverse mejor que la otra.
- Vuelve a girar el vaso durante otros 20 segundos y observa. A continuación, hazlo girar durante 20 segundos más y pide a los alumnos que hagan sus observaciones finales.
- Vuelve a verter lentamente y con cuidado la solución de cada vaso en el vaso vacío pequeño correspondiente. Intenta que los cristales que no se disolvieron no ingresen a estos vasos. Muestra a los alumnos los vasos para que puedan comparar la cantidad de cristales no disueltos que quedan.
Resultados esperados
Se disolverá mucho más azúcar que sal. En los vasos queda más sal sin disolver que azúcar.
Nota: Normalmente, la solubilidad se mide por la cantidad de gramos de una sustancia que se disuelve en un determinado volumen de agua a una temperatura determinada. La demostración anterior utiliza esta forma convencional de medir la solubilidad. Otro enfoque podría ser comparar la cantidad de moléculas o iones de cada sustancia que se disuelve en agua. Esto requeriría una manera de “contar” moléculas o iones en cada sustancia.
Obtén más sobre información sobre cómo contar moléculas o iones en Información contextual para el maestro.
- Lección 5.5 Información contextual para el maestro PDF
Paso 2
Comenta los resultados de la demostración e introduce la idea de que cada sustancia tiene su propia solubilidad característica.
Pregunta a los alumnos:
- ¿Quedó más sal o azúcar en el fondo del vaso?
Quedó más sal sin disolver en el fondo del vaso. - ¿Qué se disolvió mejor, la sal o el azúcar?
Debido a que había poco o nada de azúcar en el fondo del vaso, se debe haber disuelto más de esta en el agua. - ¿Creen que obtendremos resultados similares si volvemos a intentar disolver sal y azúcar?
Probablemente obtendremos resultados similares porque la cantidad de sal o azúcar que se disuelve tiene algo que ver con cómo interactúa cada sustancia con el agua. - El modo en que una sustancia se disuelve en agua se denomina solubilidad. ¿Esperarías que diferentes sustancias tuvieran una solubilidad igual o diferente?
Cada sustancia está compuesta por su propio tipo de moléculas que interactuarán con el agua de forma diferente. Las diferentes sustancias deben tener diferentes solubilidades.
Diles a los alumnos que compararán la solubilidad de cuatro cristales domésticos diferentes: sal (cloruro de sodio), sal de Epsom (sulfato de magnesio), MSG (glutamato monosódico) y azúcar (sacarosa). Explícales que también probarán un cristal desconocido que es químicamente igual a uno de los otros cristales. Dado que es químicamente igual, debe tener la misma solubilidad que uno de los cristales que probarán. Al final de la actividad, los alumnos deberían poder identificar el elemento desconocido.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 5.5 Hoja de actividades PDF | DOCX | Google Doc
- Lección 5.5 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Observa la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explora
Paso 3
Pide a los alumnos que intenten identificar el elemento desconocido en función de su apariencia.
Informa a los alumnos que, antes de realizar una prueba de solubilidad, analizarán atentamente los cristales para ver si podrían obtener pistas sobre la identidad del elemento desconocido solo por su aspecto. Haz que los alumnos sigan el procedimiento siguiente y registren sus observaciones acerca de los cristales en la hoja de actividades. Hazles saber a los alumnos que pueden mirar los cristales y tocarlos, pero no deben llevárselos a la boca.
Pregunta para investigar
¿Puedes identificar el cristal desconocido por el aspecto que tiene?
Materiales para cada grupo
- Papel de construcción negro
- Cinta de enmascarar
- Bolígrafo o marcador permanente
- 5 vasos de plástico pequeños
- Sal
- Sal de Epsom
- MSG
- Azúcar
- Elemento desconocido (sal kosher gruesa)
- Lupa
Preparación del maestro
- Etiqueta los 5 vasos de plástico pequeños de la siguiente manera: “Sal”, “Sal de Epsom”, “MSG”, “Azúcar” y “Desconocido”.
- Añade al menos dos cucharaditas de cada cristal al vaso etiquetado.
Procedimiento
- Utiliza cinta de enmascarar y un bolígrafo para etiquetar cuatro esquinas de un trozo de papel de construcción negro con las leyendas “Azúcar”, “Sal”, “Sal de Epsom” y “MSG”. Etiqueta el centro como “Desconocido”.
- Coloca pequeñas muestras de sal de Epsom, sal de mesa, azúcar, MSG y el elemento desconocido en las áreas etiquetadas del papel de construcción.
- Utiliza una lupa para observar cuidadosamente cada tipo de cristal.
Resultados esperados
Todos los cristales son blancos, pero algunos son más transparentes u opacos que otros. Cada tipo de cristal tiene también un tamaño y una forma diferentes.
Paso 4
Discute las observaciones de los alumnos y haz que los grupos planifiquen cómo podrían realizar una prueba de solubilidad para identificar el elemento desconocido.
Pregunta a los alumnos:
- ¿Qué notas sobre cada cristal? Incluye cualquier similitud o diferencia que observes entre ellos.
Los alumnos deben describir las propiedades físicas como el tamaño, la forma, el color y la textura. También deben describir si los cristales son brillantes, mates, transparentes u opacos. - ¿Ya puedes identificar el elemento desconocido?
Los alumnos no deberían tener pruebas suficientes para identificar correctamente el elemento desconocido en este momento. No les digas a los alumnos que el elemento desconocido es sal kosher. Lo descubrirán al final de esta lección.
Explica que observar los cristales no es suficiente para identificar el elemento desconocido. Sin embargo, una prueba de solubilidad proporcionará información útil, si las variables son bien controladas. Pide a los alumnos que piensen en cómo pueden realizar una prueba de solubilidad utilizando la sal, sal de Epsom, MSG, azúcar y el elemento desconocido. Pide a los alumnos que trabajen en grupos para debatir sus ideas y anotar un plan simple en su hoja de actividades.
Paso 5
Pide a los grupos de alumnos que compartan sus ideas para la realización de una prueba de solubilidad y ten en cuenta cómo cada plan controla las variables.
A medida que cada grupo presenta sus planes, pide a la clase que identifique cómo cada plan controla las variables. Es probable que todos los grupos sugieran que utilizarán el mismo volumen de agua a la misma temperatura en el mismo tipo de recipientes y con la misma cantidad de cada cristal. Pero puede haber cierto desacuerdo en cómo medir la misma cantidad de cada cristal. Algunos alumnos pueden sugerir utilizar el mismo volumen de cada cristal, mientras que otros pueden sugerir la misma masa de cada cristal. Si nadie sugiere usar la masa, explica que en la demostración se usó una masa igual de sal y azúcar: 5 g de cada uno.
Pregunta a los alumnos:
- ¿Es mejor utilizar el mismo volumen (como una cucharadita o 5 ml) o la misma masa (como 5 g) de cada cristal? ¿Por qué?
Diles a los alumnos que harás una demostración que les ayudará a ver si deben usar un volumen o una medida de masa para poder disolver la misma cantidad de cada cristal en agua.
Paso 6
Haz una demostración para mostrar que la masa es mejor que el volumen para medir cantidades iguales para realizar una prueba de solubilidad.
Pregunta para investigar
¿Es mejor medir el mismo volumen o la misma masa de cada cristal cuando se realiza una prueba de solubilidad para identificar un elemento desconocido?
Materiales para la demostración
- 2 vasos de plástico transparente
- Cereales redondos (Kix funciona bien)
- Bolsa plástica con cierre hermético (de un cuarto de galón, para almacenamiento)
- Balanza
Preparación del maestro
Llena completamente con cereales redondos dos vasos de plástico transparentes. Ambos vasos deben ser idénticos y contener la misma cantidad de cereales redondos. Coloca los vasos en una balanza para asegurarte de que tienen la misma masa.

Procedimiento
- Sostén los vasos llenos de cereales para que los alumnos puedan ver que ambos contienen aproximadamente la misma cantidad de cereales.
- Coloca los vasos en el centro de cada extremo de una balanza sencilla para demostrar a los alumnos que ambos contienen la misma cantidad de cereales.
Pide a los alumnos que hagan una predicción:
- Voy a triturar los cereales redondos en un vaso. ¿Esperarían que la altura de los cereales en este vaso sea mayor, menor o igual que en el otro vaso?
Los alumnos probablemente dirán que los cereales triturados no ocuparán tanta cantidad de espacio en el vaso.
- Vierte los cereales de uno de los vasos dentro de una bolsa de plástico para almacenamiento con cierre hermético. Deja salir la mayor cantidad de aire posible y sella la bolsa de manera segura.
- Coloca la bolsa en el suelo y tritura los cereales completamente con el pie. Una vez pulverizados los cereales, abre la bolsa y vierte los cereales triturados de nuevo en el vaso.
Pregunta a los alumnos:
- ¿Qué vaso contiene más cereales?
Los alumnos se darán cuenta de que ambos vasos contienen la misma cantidad de cereales, pero es posible que algunos tengan la necesidad de decir que el vaso con los cereales redondos contiene más cereales. - ¿Se añadió o se eliminó algún cereal de cualquiera de los vasos?
Señala que, aunque los cereales triturados ocupan menos espacio, sigue siendo la misma cantidad de materia (cereales) que la que había en el vaso antes de triturarlos. - ¿Cómo podrías demostrar que estos dos vasos contienen la misma cantidad de materia?
Los alumnos deben sugerir poner los vasos en la balanza como se hizo antes.
- Coloca los vasos en los extremos opuestos de una balanza para demostrar que la masa de cereales en cada vaso es la misma.
Resultados esperados
Aunque el volumen de los cereales redondos es mayor que el volumen de los cereales redondos triturados, los vasos se equilibran en la balanza.
Paso 7
Relaciona las observaciones de los alumnos en la demostración con los cinco cristales que disolverán en agua.
Diles a los alumnos que imaginen que los cereales redondos grandes representan a los cristales grandes y los cereales triturados representan a los cristales pequeños. Explica que el tamaño y la forma de los cristales pueden ser diferentes, pero la balanza muestra que su masa es la misma. Recuerda a los alumnos que la masa es una medida de la cantidad de materia. Dado que los cristales grandes y los pequeños (cereales) tienen la misma masa, ambos vasos contienen la misma cantidad de materia. Concluye que, para medir cantidades iguales, es mejor medir la masa de las sustancias que su volumen.
Pregunta a los alumnos:
- En la prueba de solubilidad que realizarás, tendrán que medir cantidades iguales de los cinco cristales. ¿Cómo medirán cantidades iguales?
Después de esta demostración, los alumnos deben darse cuenta de que, para una prueba de solubilidad, es mejor medir la masa que medir el volumen.
En base a lo que los alumnos observaron cuando analizaron de cerca los diferentes cristales junto con las pruebas de la demostración, deben darse cuenta de que los diferentes cristales tienen un tamaño o una forma ligeramente diferentes. Esto hará que se dispongan de forma diferente en la cuchara para que en la cuchara haya más gránulos de uno que del otro.
Nota: La siguiente explicación puede ser demasiado difícil para los alumnos, pero se incluye aquí para que la tengas en cuenta y hables con los alumnos si crees que es apropiado. Incluso si los gránulos de sal y azúcar tuvieran exactamente el mismo tamaño y forma, y se dispusieran exactamente de la misma manera en una cuchara, no sería una buena idea utilizar una cuchara de té para medir cantidades iguales con fines de realizar una prueba de solubilidad. Por este motivo: La sal es aproximadamente un 25 % más densa que el azúcar. Por lo tanto, una cucharadita de sal pesa casi un 25 % más que una cucharadita de azúcar. La prueba de disolución no sería precisa porque estarías comenzando con una masa de sal mayor que la del azúcar.
Paso 8
Pide a los alumnos que pesen cinco gramos de cada uno de los cristales para la prueba de solubilidad.
Materiales para cada grupo
- Balanza en gramos
- 5 vasos de plástico pequeños
- 5 vasos de plástico transparente
- Cinta de enmascarar y bolígrafo o marcador permanente
- Sal
- Sal de Epsom
- MSG
- Azúcar
- Elemento desconocido (sal kosher gruesa)
- Agua
Procedimiento
- Utiliza cinta de enmascarar y un bolígrafo para etiquetar los 5 vasos pequeños de plástico: “Sal”, “Sal de Epsom”, “MSG”, “Azúcar” y “Desconocido”.
- Etiqueta los 5 vasos de plástico transparente más grandes del mismo modo.
- Pesa 5 g de cada cristal y coloca cada uno en su pequeño vaso etiquetado.
Si no tienes tiempo suficiente, puedes detenerte aquí y hacer que los alumnos guarden los cristales y realicen la prueba otro día. Si tienes tiempo para realizar la prueba, sigue con el procedimiento.
Paso 9
Haz que los alumnos disuelvan los cuatro cristales conocidos y el elemento desconocido en agua a temperatura ambiente.
La cantidad de agua utilizada en el procedimiento es específica y debe utilizarse así porque proporciona resultados claros. Hacer girar los cristales en agua es una buena forma de mezclarlos para ayudar a que se disuelvan. Guía a la clase para que todos los grupos viertan sus muestras de cristal en el agua al mismo tiempo. Indica también a los alumnos cuándo deben agitar el agua y los cristales y cuándo detenerse y observar. Habrá tres intervalos de 20 segundos.
Pregunta para investigar
¿Puedes identificar un elemento desconocido mediante una prueba de solubilidad?
Materiales para cada grupo
- Cilindro graduado
- 5 g de cada uno de sal, sal de Epsom, MSG, azúcar y el elemento desconocido (sal gruesa kosher)
- 5 vasos de plástico transparente
- Agua
Procedimiento
- Utiliza un cilindro graduado para añadir 5 ml de agua a temperatura ambiente a cada vaso de plástico transparente vacío.
- Haz coincidir cada par de vasos etiquetados de manera que cada vaso con los cristales esté cerca de su vaso de agua correspondiente.

- Cuando tu maestro te lo indique, trabaja con tus compañeros de laboratorio para introducir la cantidad que han pesado de cada cristal en el vaso de agua correspondiente, al mismo tiempo.
- Con la ayuda de tus compañeros de laboratorio, haz girar cada vaso al mismo tiempo y de la misma manera durante unos 20 segundos, y observa. Vuelve a girarlo durante otros 20 segundos y observa. Vuelve a girarlo durante los últimos 20 segundos y realiza tus observaciones finales.

- Vierte lentamente y con cuidado la solución de cada vaso en el vaso vacío pequeño correspondiente. Intenta que los cristales que no han sido disueltos no ingresen al vaso pequeño. Compara la cantidad de cristal restante en cada vaso de plástico transparente.
Resultados esperados
Los resultados pueden variar. Sin embargo, el azúcar debe disolverse más, seguida de la sal de Epsom. Debería parecer que el MSG se disuelve un poco más que la sal y que el elemento desconocido. La sal y el elemento desconocido deben parecer disolverse en similar medida.
Paso 10
Comenta las observaciones de los alumnos y la posible identidad del elemento desconocido.
Pregunta a los alumnos:
- ¿Hay algún cristal que puedan descartar como que probablemente no sea el elemento desconocido?
En base a sus observaciones, es más probable que los alumnos descarten el azúcar y la sal de Epsom como el elemento desconocido. - ¿Qué vaso o vasos parecen tener aproximadamente la misma cantidad de cristal sin disolver que el elemento desconocido?
El elemento desconocido, la sal y el MSG parecen tener una cantidad similar de cristales sin disolver. - ¿Cuál creen que es la identidad del elemento desconocido?
Los alumnos podrían llegar a la conclusión de que el elemento desconocido es la sal, pero pueden también pensar que podría ser el MSG. - ¿Qué pruebas tienes para respaldar tu conclusión?
Los alumnos deben citar la cantidad de cristal que queda en cada vaso como prueba de que el elemento desconocido es la sal o el MSG - Si alguien de la clase llegó a una conclusión muy diferente y tuvo observaciones muy diferentes, ¿qué crees que puede haber provocado estas diferencias?
Los alumnos deben mencionar posibles errores al pesar los cristales, al medir la cantidad de agua utilizada, al agitar de una manera diferente o al verter accidentalmente los cristales en los vasos equivocados.
Diles a los alumnos que su prueba mostró que las diferentes sustancias tienen diferentes solubilidades. De hecho, la solubilidad es una propiedad característica de una sustancia. Explica a los alumnos que este tipo de prueba de solubilidad puede ayudar a eliminar algunos de los cristales, pero puede no ser lo suficientemente precisa como para identificar el elemento desconocido. Dado que pueden tener alguna duda sobre la identidad del elemento desconocido, los alumnos realizarán una prueba de recristalización con las soluciones cristalinas realizadas durante la prueba de solubilidad.
Paso 11
Pide a los alumnos que realicen otra prueba para confirmar la identidad del elemento desconocido.
Explica a los alumnos que podrían obtener más pistas sobre la identidad del elemento desconocido si permiten que las soluciones de los cristales disueltos recristalicen. Permitir que las sustancias se recristalicen a partir de sus soluciones podría mostrar similitudes y diferencias que no fuesen tan fácilmente visibles en los cristales originales.
Nota sobre los materiales: La prueba de recristalización debe realizarse inmediatamente después de la prueba de solubilidad con las soluciones hechas durante la prueba de solubilidad. Los alumnos reutilizarán los vasos grandes de plástico transparente y las soluciones de la parte de disolución de la actividad, de acuerdo con el procedimiento.
Pregunta para investigar
¿Los cristales que se forman cuando se evaporan las soluciones ayudan a identificar un elemento desconocido?
Materiales para cada grupo
- Cinco soluciones hechas en la actividad, cada una en un pequeño vaso de plástico
- 5 vasos de plástico transparentes de la actividad
- Lupa
- Agua
- Toalla de papel
Procedimiento
- Enjuaga cada vaso de plástico transparente grande con agua para eliminar cualquier cristal restante. Seca cada uno de ellos con una toalla de papel.
- Vierte con cuidado la solución de cada vaso pequeño en el vaso de plástico transparente correspondiente.
- Deja que las soluciones se asienten durante la noche.
- Al día siguiente, utiliza una lupa para observar cuidadosamente los cristales de la parte superior e inferior del vaso.
Resultados esperados
La sal y el elemento desconocido tienen un aspecto muy similar. La sal de Epsom, el MSG y el azúcar se ven distintos entre sí y distintos a la sal y el elemento desconocido. Es posible que el azúcar aún no se haya recristalizado, pero si se le da más tiempo, formará cristales.
Pregunta a los alumnos:
- Describan los cristales en cada vaso. ¿Cuál creen que es la identidad del elemento desconocido?
Los alumnos deben hablar sobre la forma y el tamaño de los diferentes cristales y observar que tanto la sal como el elemento desconocido son muy similares.
Diles a los alumnos que el elemento desconocido es sal kosher gruesa. Es químicamente igual que la sal normal, pero el proceso de fabricación de la sal de mesa y de la sal kosher es diferente y por eso tienen un aspecto diferente.
4 Explica
Paso 12
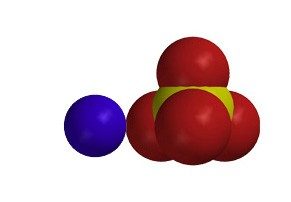
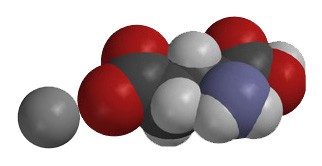
Muestra modelos moleculares de sal, sal de Epsom, azúcar y MSG.
Proyecta la imagen Los cuatro cristales.
Explica que, debido a que estas sustancias están compuestas por diferentes átomos e iones unidos de forma diferente, interactúan con el agua de manera diferente, lo que les da a cada una su propia solubilidad característica.
- Sal
Recuerda a los alumnos que el cloruro de sodio es un compuesto iónico. Hay un ion de sodio positivo (Na+) y un ion de cloruro negativo (Cl–). El agua polar interactúa con estos iones cargados de forma opuesta para disolver la sal. - Sal de Epsom
Diles a los alumnos que la sal de Epsom es un compuesto iónico. Hay un ion de magnesio positivo (Mg2+) y un ion de sulfato negativo (SO2–). El agua polar interactúa con estos iones cargados de forma opuesta para disolver la sal de Epsom. - MSG
El MSG está compuesto por un ion de sodio positivo (Na+) y un ion de glutamato negativo, que tiene la fórmula molecular (C5H8NO–). El agua polar interactúa con estos iones cargados de forma opuesta para disolver el MSG. - Azúcar
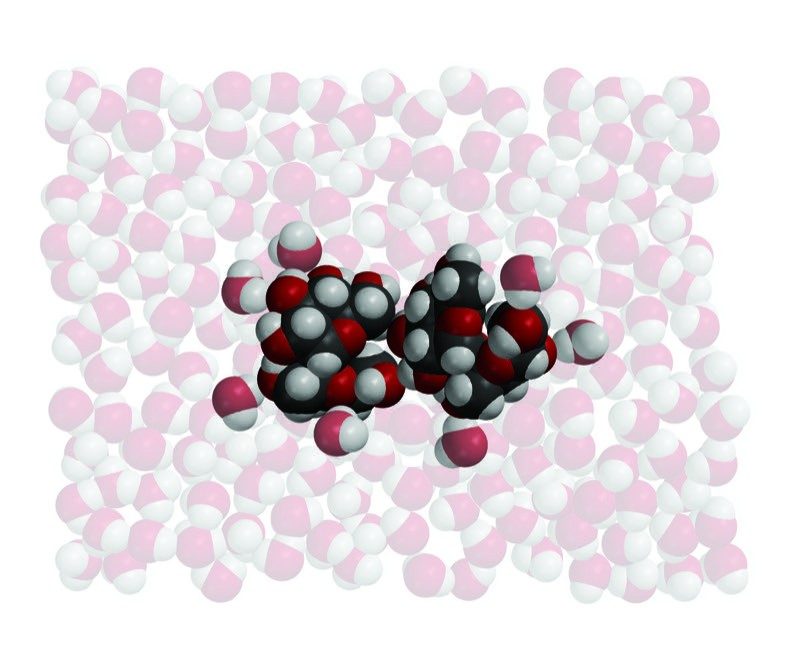
La sacarosa no es un compuesto iónico. La sacarosa tiene muchos enlaces O–H, que le dan áreas polares positivas y negativas. Estas áreas atraen otras moléculas de sacarosa y las mantienen unidas en forma de cristal. Estas áreas polares interactúan con el agua y hacen que moléculas de sacarosa enteras se separen entre sí, y se disuelvan.
5 Amplía
Paso 13
Ayuda a los alumnos a revisar las similitudes y diferencias en la forma en que la sal y el azúcar se disuelven en agua.
Diles a los alumnos que, en función de la sustancia que se disuelve, los iones se separan entre sí o las moléculas se separan entre sí. La sal y el azúcar son ejemplos comunes de disolución de ambos tipos de sólidos.
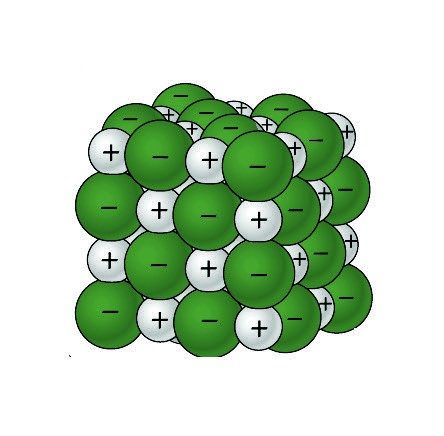
Proyecta la imagen El agua disuelve la sal.
Pregunta a los alumnos:
- Cuando se disuelve la sal, ¿por qué se atraen las moléculas de agua a los iones de sodio y cloruro?
El cloruro de sodio es un compuesto iónico con un ion de sodio positivo (Na+) y un ion de cloruro negativo (Cl–). El agua polar interactúa con estos iones cargados de forma opuesta para hacer que se disuelva.
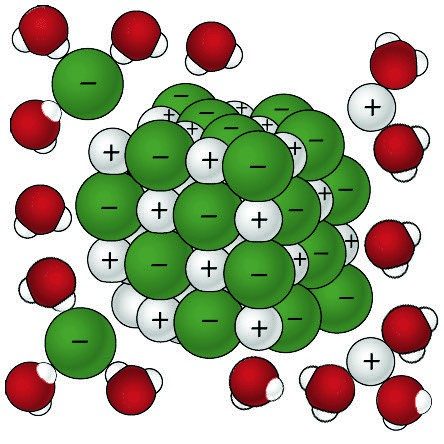
Proyecta la imagen El agua disuelve el azúcar.
Pregunta a los alumnos:
- Cuando el azúcar se disuelve, ¿por qué se atraen las moléculas de agua a las moléculas de sacarosa?
La sacarosa tiene muchos enlaces O–H, que le dan áreas polares positivas y negativas. Estas áreas atraen otras moléculas de sacarosa y las mantienen unidas en forma de cristal. Estas áreas polares interactúan con el agua y hacen que moléculas de sacarosa enteras se separen entre sí, y se disuelvan. - ¿Cuáles son las similitudes y diferencias entre el agua que disuelve la sal y el agua que disuelve el azúcar?
Los iones de sodio y cloruro se separan unos de otros y se rodean de moléculas de agua a medida que se disuelven. Moléculas enteras de sacarosa se separan de otras moléculas de sacarosa. Los enlaces covalentes que sostienen los átomos en la molécula de sacarosa no se rompen.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Simulaciones
Vea todas las imágenes de la Lección 5.5 en la página de simulaciónes.
Descargas
Para los estudiantes
- Lección 5.5 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 5.5 Plan de lección PDF | DOCX | Google Doc
- Lección 5.5 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
- Lección 5.5 Información contextual para el maestro PDF
Recursos para el Capítulo 5
- Capítulo 5 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 5 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda