Cambios de temperatura durante la disolución
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- El proceso de disolución puede ser endotérmico (la temperatura desciende) o exotérmico (la temperatura sube).
- Cuando el agua disuelve una sustancia, las moléculas de agua se atraen y se “enlazan” a las partículas (moléculas o iones) de la sustancia, lo que hace que las partículas se separen entre sí.
- El “enlace” que produce una molécula de agua no es un enlace covalente o iónico. Es una fuerte atracción causada por la polaridad del agua.
- Se requiere energía para romper los enlaces entre las moléculas o los iones del soluto.
- Se libera energía cuando las moléculas de agua se unen a las moléculas o iones del soluto.
- Si se necesita más energía para separar las partículas del soluto que la que se libera cuando las moléculas de agua se unen a las partículas, la temperatura disminuye (endotérmico).
- Si se necesita menos energía para separar las partículas del soluto que la que se libera cuando las moléculas de agua se unen a las partículas, la temperatura aumenta (exotérmico).
Resumen
Los alumnos notarán el cambio de temperatura que se produce cuando un paquete frío y un paquete caliente se activan. Verán que estos cambios de temperatura se deben a la disolución de una sustancia sólida en agua. A continuación, los alumnos compararán los cambios de temperatura que se producen con la disolución de cuatro solutos diferentes en agua y los clasificarán como endotérmicos o exotérmicos. Se presentará a los alumnos el concepto de que se necesita energía para romper enlaces y liberar energía cuando se forman enlaces durante el proceso de disolución.
Objetivo
Los alumnos podrán identificar variables en un experimento para averiguar cuánto aumenta o disminuye la temperatura a medida que cada uno de los cuatro solutos se disuelve en agua. Los alumnos podrán clasificar correctamente el proceso de disolución como exotérmico o endotérmico para cada soluto. Los alumnos serán capaces de explicar que los cambios de temperatura en la disolución son resultado de la cantidad de energía liberada en comparación con la cantidad de energía utilizada a medida que se forman y rompen los “enlaces”.

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas. El exceso de material seco de las bolsas caliente y fría se puede desechar en la basura. El carbonato de sodio puede ser irritante para la piel. Pide a los alumnos que se laven las manos después de la actividad.
Materiales para las demostraciones
- 2 paquetes fríos desechables
- 2 paquetes calientes desechables
- Cilindro graduado
- Agua (a temperatura ambiente)
- 2 vasos de plástico transparente
- 2 termómetros
Materiales para cada grupo
- Cloruro de potasio
- Cloruro de calcio
- Carbonato de sodio
- Bicarbonato de sodio
- Agua
- 5 vasos pequeños
- Cilindro graduado
- Termómetro
- Balanza en gramos
Notas sobre los materiales
- Los paquetes fríos y calientes utilizados en esta lección contienen urea (paquete frío) y sulfato de magnesio (paquete caliente) sellada en una bolsa con una bolsa llena de agua en su interior. Los paquetes calientes (paquetes instantáneos para ayuda rápida) pueden comprarse en www.amazon.com
- El calentador de manos que se muestra en el video en la sección Extensión contiene una solución supersaturada de acetato de sodio con un pequeño disco metálico dentro de una bolsa de plástico transparente. Este calentador se activa doblando ligeramente el disco metálico. Estos calentadores de manos, llamados The Heat Solution, están disponibles en Flinn Scientific, número de producto AP1933, y pueden ser adquiridos de varios otros proveedores.
- El cloruro de potasio se puede comprar en un supermercado con el nombre comercial Nu-Salt Salt Sustitute o en Flinn Scientific, número de producto P0042.
- El cloruro de calcio se puede adquirir en una ferretería con el nombre comercial DampRid o pedir cloruro de calcio anhidro con número de producto C0016 a Flinn Scientific.
- El carbonato de sodio anhidro se puede adquirir en Flinn Scientific, número de producto S0052.
- El bicarbonato de sodio es el que se usa en la cocina. También se puede comprar en Flinn Scientific, número de producto S0043.
Nota: Esta actividad se ocupa de un concepto que no suele abordarse en la escuela secundaria: que se produce un cambio de temperatura durante el proceso de disolución. La mayoría de los libros de texto y programas de estudios de educación secundaria asocian un cambio de temperatura solo con un cambio químico. La disolución normalmente se considera un cambio físico, pero también puede provocar un cambio de temperatura. Este cambio en la temperatura se basa en los cambios energéticos que están involucrados en la ruptura y formación de “enlaces” durante el proceso de disolución.
Conoce más acerca de los cambios energéticos durante la creación y ruptura de enlaces en la Información contextual para el maestro.
- Lección 5.9 Información contextual para el maestro PDF
Descarga todos los recursos de la Lección 5.9
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 5.9: Cambios de temperatura durante la disolución."
Instrucciones
1 Involúcrate
Paso 1
Deja que los alumnos sientan el cambio de temperatura en un paquete frío activado y un paquete caliente activado.
Diles a los alumnos que explorarán cómo funcionan algunos paquetes calientes y fríos. Dales una pista de que tiene que ver con la disolución, la que han estado estudiando en este capítulo.
Materiales para la demostración
- 1 paquete frío desechable
- 1 paquete caliente desechable

Procedimiento
- Selecciona dos voluntarios entre los alumnos: uno para activar un paquete frío y otro para activar un paquete caliente.
- Haz que cada alumno sienta cada bolsa y adivine lo que hay dentro de cada una. Deberían notar la presencia de un sólido én gránulos y una bolsa llena de líquido. Señala que las bolsas aún no se sienten frías ni calientes.
- Indica a los alumnos que activen sus paquetes siguiendo las instrucciones del envase. Pídeles que agiten los paquetes para que el líquido se extienda por toda la bolsa.
- Haz circular las bolsas frías y calientes por la sala.
Resultados esperados
El paquete frío se enfría rápidamente mientras que el paquete caliente se calienta rápidamente.
Paso 2
Haz una demostración para ver cómo funcionan los paquetes calientes y fríos.
Nota: En esta demostración, se disuelve 1 cucharadita de cada sustancia en 10 ml de agua. Dado que el propósito de esta demostración es mostrar si la temperatura simplemente sube o baja, esta medida del volumen es aceptable. Pero, para comparar qué sustancia es más o menos exotérmica o endotérmica que otra, como harán los alumnos en la actividad, el soluto se medirá en gramos.
Materiales para la demostración
- 1 paquete frío desechable
- 1 paquete caliente desechable
- Cilindro graduado, 50 ml o más pequeño
- Agua (a temperatura ambiente)
- 2 vasos de plástico transparente
- 2 termómetros
- 1 cucharadita
Procedimiento
- Corta con cuidado un paquete frío y un paquete caliente para abrirlos. Muestra a los alumnos el contenido, pero no manipules ni permitas que los alumnos manipulen la sustancia sólida dentro de los paquetes.
- Diles a los alumnos que el líquido que hay dentro de las bolsas llenas de líquido tanto del paquete frío como del caliente es agua. Vierte unos 10 ml de agua a temperatura ambiente en dos vasos de plástico transparente por separado.
- Coloca un termómetro en cada vaso y selecciona dos alumnos voluntarios para que indiquen a la clase cuál es la temperatura inicial del agua en cada vaso.

- Con el termómetro aún en el vaso, añade aproximadamente 1 cucharadita de la sustancia sólida del paquete frío al agua en un vaso. Gira suavemente el vaso para que la sustancia se disuelva. Pide a la clase que mire el termómetro y luego pide a un alumno que le diga a la clase la temperatura más baja de la solución.
- Con el termómetro aún en el vaso, añade aproximadamente 1 cucharadita de la sustancia sólida del paquete caliente al agua en el otro vaso. Gira suavemente el vaso para que la sustancia se disuelva. Pide a la clase que mire el termómetro y luego pide a un alumno que le informe a la clase cuál es la temperatura más alta de la solución.
Resultados esperados
La disolución de la sustancia del paquete frío hará que la temperatura disminuya a menos de 10 °C (endotérmica). La disolución de la sustancia del paquete caliente hará que la temperatura aumente a más de 40 °C (exotérmica). Los resultados pueden variar.
Paso 3
Presenta los términos endotérmico y exotérmico.
Diles a los alumnos que los científicos describen los cambios de temperatura que se producen cuando las sustancias interactúan como endotérmicos o exotérmicos. Cuando la temperatura disminuye, como lo hace en el paquete frío, el proceso es endotérmico. Cuando la temperatura aumenta, como lo hace en el paquete caliente, el proceso es exotérmico.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 5.9 Hoja de actividades PDF | DOCX | Google Doc
- Lección 5.9 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán junto con la clase, en grupos o individualmente, según tus instrucciones. Observa la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explora
Paso 4
Presenta la actividad de disolución que harán los alumnos y ayúdalos a identificar las variables.
Diles a los alumnos que compararán cuánto cambia la temperatura al disolver en agua cuatro sustancias domésticas. Presenta los cristales que los alumnos deberán disolver:
- El cloruro de potasio es un sustituto frecuente de la sal.
- El cloruro de calcio se utiliza para absorber la humedad del aire. También se incluye en algunas mezclas para hielo para tratar las aceras heladas durante el invierno.
- El carbonato de sodio es un ingrediente común de los detergentes para lavavajillas.
- El bicarbonato de sodio, también conocido como polvo para hornear, se utiliza en la cocción, en la pasta de dientes y en muchas otras aplicaciones.
Pregunta a los alumnos:
- ¿Cómo podemos establecer una comparación razonable para averiguar qué soluto es el más endotérmico y cuál es el más exotérmico al disolverlo en agua?
Asegúrate de que los alumnos utilicen la misma cantidad de cada soluto. Basándose en lo que han aprendido en el Capítulo 5, Lección 5, los alumnos deben darse cuenta de que cada cristal debe pesarse en gramos. Los alumnos también deben recordar que deben consumir la misma cantidad de agua a la misma temperatura. Diles a los alumnos que en esta actividad tendrán que agitar los solutos en el agua para ayudarles a que se disuelvan más rápido. Deben tener cuidado de agitar cada vaso de la misma manera para cada prueba.
Nota: Comparar el grado del cambio de temperatura para diferentes sustancias mediante la disolución de la misma masa de cada sustancia en la misma cantidad de agua es apropiado para el nivel de la escuela media. Sin embargo, un enfoque más riguroso es disolver la mismo cantidad de partículas (moléculas o unidades iónicas) de cada sustancia en la misma cantidad de agua.
Obtén más información cómo contar moléculas en la Información contextual para el maestro.
- Lección 5.9 Información contextual para el maestro PDF
Paso 5
Pide a los alumnos que controlen los cambios de temperatura a medida que disuelven cuatro solutos domésticos diferentes en agua.
Pregunta para investigar
¿Qué soluto se disuelve de manera más endotérmica y cuál se disuelve de manera más exotérmica en agua?
Materiales para cada grupo
- Cloruro de potasio
- Cloruro de calcio
- Carbonato de sodio
- Bicarbonato de sodio
- Agua
- 5 vasos pequeños
- Marcador permanente o cinta de enmascarar y bolígrafo
- Cilindro graduado
- Termómetro
- Balanza en gramos

Procedimiento
- Coloca etiquetas en los vasos de plástico pequeños con los nombres cloruro de potasio, cloruro de calcio, carbonato de sodio y bicarbonato de sodio.
- Pesa 2 g de cada soluto y colócalos en los recipientes etiquetados.
- Añade 10 ml de agua en el vaso pequeño sin etiquetar y coloca un termómetro en el agua. Registra esta temperatura inicial en la tabla de la hoja de actividades.
- Vierte el cloruro de potasio en el agua y mueve el recipiente en círculos. Observa el termómetro.
- Cuando la temperatura deje de cambiar, registra la temperatura final.
- Repite los pasos 3 a 5 para cada soluto.
Resultados esperados
El cloruro de potasio se disolvió de manera más endotérmica y el cloruro de calcio se disolvió de manera más exotérmica. Las lecturas de temperatura de los alumnos variarán, pero probablemente serán similares a las siguientes:
| Soluto disuelto en agua a temperatura ambiente (22 °C) | Temperatura máxima o mínima alcanzada | ¿Endotérmico o exotérmico? |
| Cloruro de potasio | 14 °C | Endotérmico |
| Cloruro de calcio | 45 °C | Exotérmico |
| Cloruro de sodio | 32 °C | Exotérmico |
| Bicarbonato de sodio | 18 °C | Endotérmico |
Paso 6
Analiza las observaciones de los alumnos.
Pregunta a los alumnos:
- ¿Qué solutos se disolvieron de manera endotérmica?
Cloruro de potasio y bicarbonato de sodio - ¿Qué soluto se disolvió de la manera más endotérmica?
Cloruro de potasio - ¿Qué solutos se disolvieron de manera exotérmica?
Cloruro de calcio y carbonato de sodio - ¿Qué soluto se disolvió de la manera más exotérmica?
Cloruro de calcio
4 Explica
Paso 7
Muestra a los alumnos una animación de disolución y explica que la energía al formar y romper “enlaces” durante la disolución provoca un cambio en la temperatura.
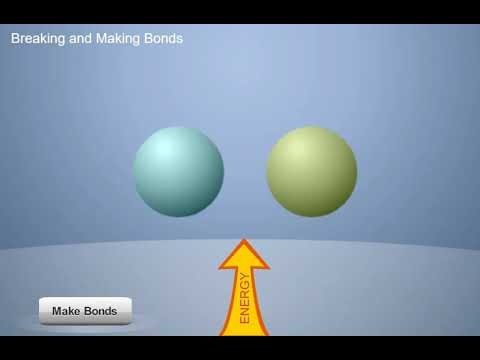
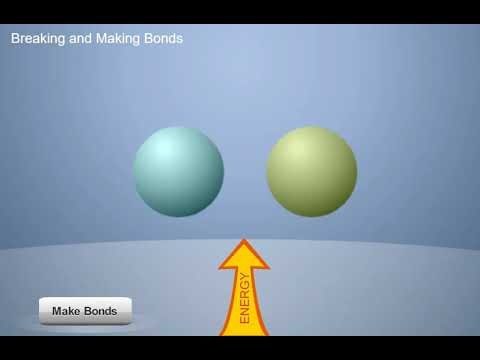
Proyecta la animación Formar y romper enlaces.
Diles a los alumnos que existe una regla importante en química: Se requiere energía para separar átomos, iones o moléculas que se atraen entre sí. Pero cuando se unen átomos, iones o moléculas, se libera energía. Una manera de decirlo es, “Se necesita energía para romper los enlaces y se libera energía cuando se forman enlaces”.
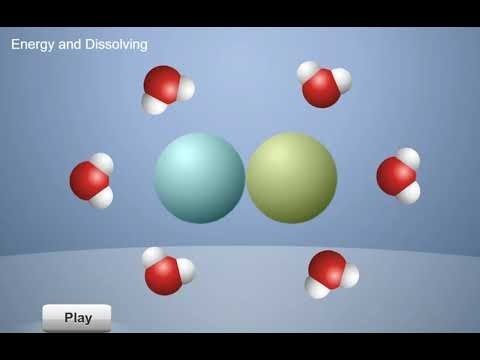
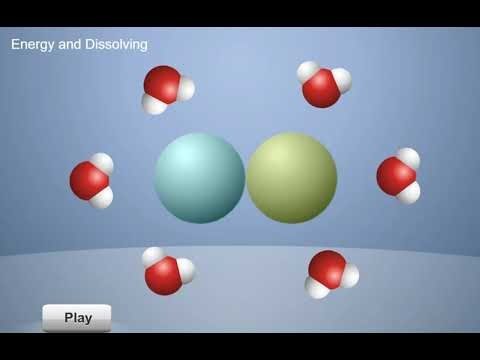
Proyecta la animación Energía y disolución.
Pulsa el botón “siguiente” y explica que esto sucede durante la disolución. Cuando las moléculas de agua son atraídas a las moléculas o los iones de una sustancia, y se unen a ellos, se libera cierta cantidad de energía, como muestra la flecha que sale. A continuación, las moléculas de agua separan los iones o las moléculas de la sustancia, lo que requiere energía, como muestra la flecha que entra.
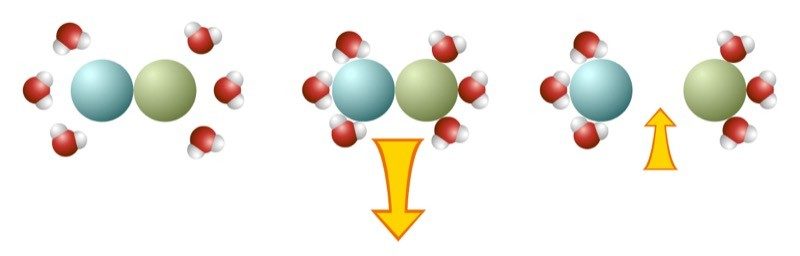
Proyecta la imagen Disolución exotérmica.
El proceso de disolución es exotérmico cuando se libera más energía cuando las moléculas de agua se “enlazan” al soluto que la que se utiliza para separar el soluto. Dado que se libera más energía que la que se utiliza, las moléculas de la solución se mueven más rápido, lo que hace que la temperatura aumente.
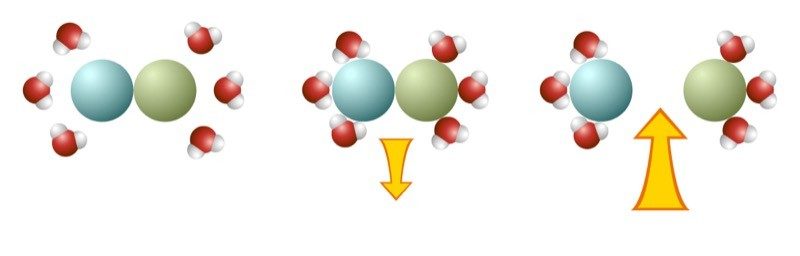
Proyecta la imagen Disolución endotérmica.
El proceso de disolución es endotérmico cuando se libera menos energía cuando las moléculas de agua se “enlazan” al soluto que la que se utiliza para separar el soluto. Dado que se libera menos energía que la que se utiliza, las moléculas de la solución se mueven más lentamente, lo que hace que la temperatura disminuya.
5 Amplía
Paso 8
Descubre si el proceso de cristalización puede causar un cambio de temperatura.
Proyecta el video Calentador de manos.
En el calentador de manos, las moléculas de agua y los iones del soluto se unen para formar un cristal. Doblar el disco metálico crea pequeñas rayaduras, que actúan como puntos de nucleación en los que se forma el cristal de acetato de sodio. A medida que las moléculas de agua y los iones se unen en el cristal en crecimiento, se libera energía. Esto provoca un aumento de la temperatura.
Paso 9
Los líquidos que se disuelven en un líquido también pueden provocar un cambio de temperatura.
Proyecta el video Cambio de temperatura, alcohol en agua.
Explica que el “enlace” de las moléculas de agua a las moléculas de alcohol libera más energía que la que se necesita para separar las moléculas de alcohol entre sí. Esto provoca un aumento de la temperatura.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Descargas
Para los estudiantes
- Lección 5.9 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 5.9 Plan de lección PDF | DOCX | Google Doc
- Lección 5.9 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
- Lección 5.9 Información contextual para el maestro PDF
Recursos para el Capítulo 5
- Capítulo 5 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 5 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda