Niveles de energía, electrones y enlaces iónicos
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- Las atracciones entre los protones y los electrones de los átomos pueden hacer que un electrón se traslade completamente de un átomo al otro.
- Cuando un átomo pierde o gana un electrón, se lo denomina ion.
- El átomo que pierde un electrón se convierte en un ion positivo.
- El átomo que gana un electrón se convierte en un ion negativo.
- Un ion positivo y negativo se atraen entre sí, formando un enlace iónico.
Resumen
Los alumnos verán animaciones y harán dibujos del enlace iónico del cloruro de sodio (NaCl). Los alumnos verán que los enlaces iónicos y covalentes comienzan con las atracciones de los protones y electrones entre átomos diferentes. Pero en el enlace iónico, los electrones se transfieren de un átomo a otro y no se comparten como en los enlaces covalentes. Los alumnos usarán esferas de poliestireno para hacer modelos de enlace iónico en el cloruro de sodio (sal).
Objetivo
Los alumnos podrán explicar el proceso de formación de iones y enlaces iónicos.

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas.
Materiales para cada grupo
- Papel negro
- Sal
- Recipiente con sal a partir de agua salada evaporada
- Lupa
- Marcador permanente
Materiales para cada alumno
- 2 esferas de poliestireno pequeñas
- 2 esferas de poliestireno grandes
- 2 palillos de dientes
Nota: En una sustancia iónicamente enlazada como el NaCl, la menor proporción de iones positivos y negativos enlazados se denomina “unidad de fórmula” en lugar de “molécula”. En términos técnicos, el término “molécula” se refiere a dos o más átomos que se enlazan de manera covalente, no iónica. Por motivos de simplicidad, es posible que desees usar el término “molécula” para las sustancias con enlaces covalentes e iónicos.
Descarga todos los recursos de la Lección 4.5
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 4.5: Niveles de energía, electrones y enlaces iónicos."
Instrucciones
1 Involúcrate
Paso 1
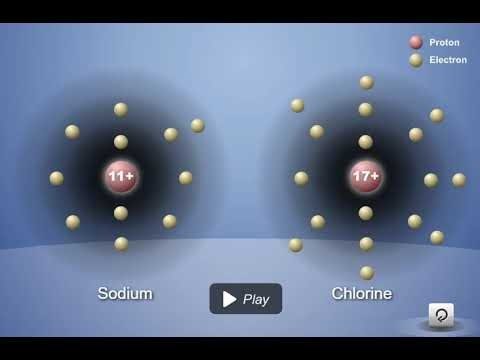
Muestra un video de la reacción entre metal de sodio y gas de cloro.
Proyecta el video “El sodio y el cloro reaccionan.”
Antes de comenzar el video, diles a los alumnos que el cloro es un gas verdoso venenoso y el sodio es un metal brillante, suave y muy reactivo. Pero cuando reaccionan, forman cloruro de sodio (sal de mesa). Diles a los alumnos que en el video, la gota de agua ayuda a exponer los átomos de la superficie del sodio para que puedan reaccionar con el cloro. La formación de cristales de sal libera mucha energía.
Nota: Si los alumnos preguntan si la sal que comen se prepara de esta manera en fábricas de sal, la respuesta es no. La sal en la Tierra se produjo miles de millones de años atrás, pero probablemente no a partir de gas de cloro puro y metal de sodio. En la actualidad, obtenemos la sal a partir de la extracción de un mineral llamado halita o del agua de mar evaporada.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 4.5 Hoja de actividades PDF | DOCX | Google Doc
- Lección 4.5 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán junto con la clase, en grupos o individualmente, según tus instrucciones. Observa la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explica
Paso 2
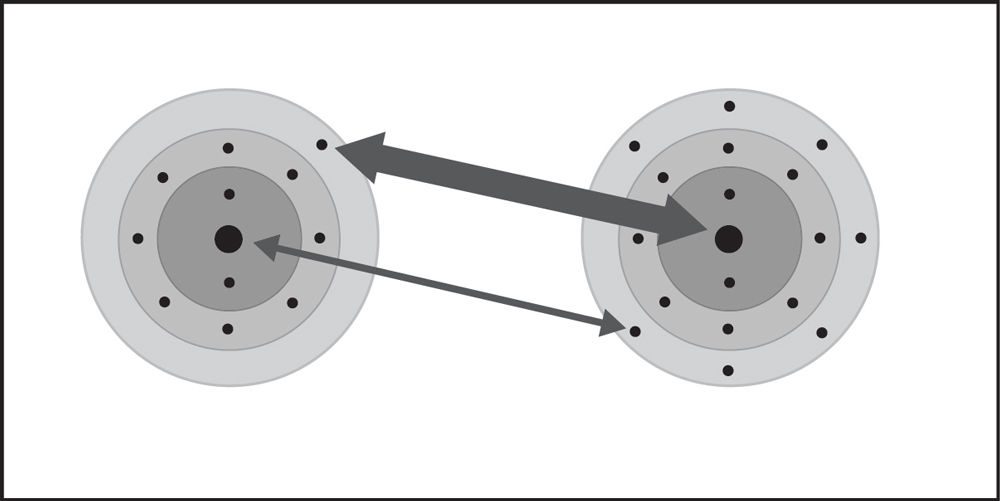
Muestra una animación para presentar el proceso de enlace iónico.
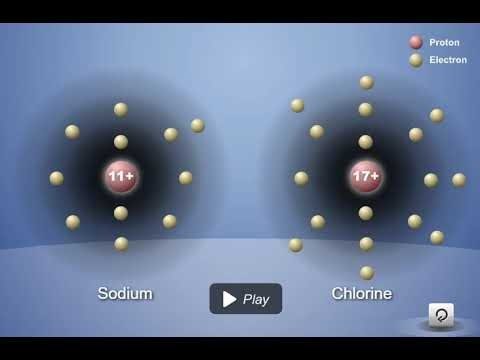
Proyecta la animación Enlace iónico en cloruro de sodio.
Recuerda a los alumnos que en el enlace covalente, los átomos comparten electrones. Pero hay otro tipo de enlace en el que los átomos no comparten, sino que toman o ceden electrones. Este se denomina enlace iónico. La siguiente animación muestra un modelo muy simplificado de cómo se forman los iones de sodio y cloruro.
Nota: A fin de simplificar el modelo de enlace iónico, se muestra un único átomo de sodio y cloro. En realidad, el átomo de cloro estaría unido a otro átomo de cloro como parte del gas Cl2. El átomo de sodio sería uno de los miles de millones de átomos de sodio que están unidos para formar un sólido. La combinación de estas sustancias es una reacción compleja entre los átomos de las dos sustancias. La animación muestra átomos únicos separados para ilustrar la idea de cómo se forman los iones y los enlaces iónicos.
Durante la animación, explica lo que sucede.
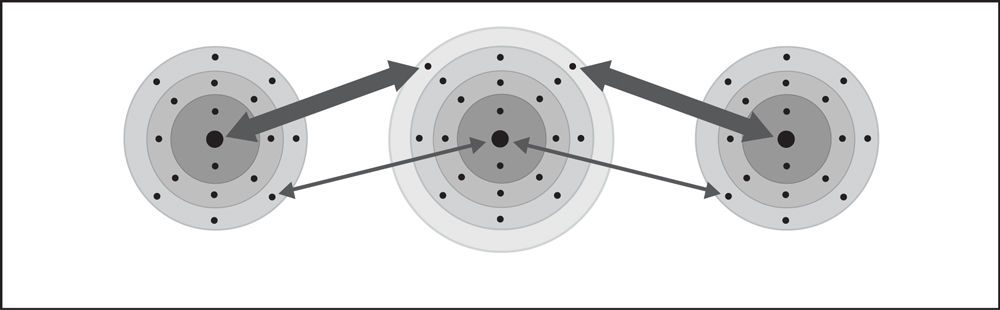
Diles a los alumnos que la atracción de los protones en el sodio y el cloro con respecto a los otros electrones del átomo los acerca entre sí. El cloro tiene una atracción más potente que el sodio por los electrones (se muestra con la flecha más gruesa). En algún momento durante este proceso, un electrón de sodio se transfiere al cloro. El sodio pierde un electrón y el cloro gana un electrón.
Diles a los alumnos que cuando un átomo gana o pierde un electrón, se convierte en un ion.
- El sodio pierde un electrón, dejándolo con 11 protones, pero solo con 10 electrones. Dado que tiene 1 protón más que la cantidad de electrones que tiene, el sodio tiene una carga de +1, lo que lo convierte en un ion positivo.
- El cloro gana un electrón, dejándolo con 17 protones y 18 electrones. Debido a que tiene 1 electrón más que los protones que tiene, el cloro tiene una carga de -1, lo que lo convierte en un ion negativo.
- Cuando se forman iones, los átomos ganan o pierden electrones hasta que su nivel externo de energía está completo.
- Por ejemplo, cuando el sodio pierde su único electrón externo del tercer nivel de energía, el segundo nivel se convierte en el nuevo nivel externo de energía y se completa. Dado que estos electrones están más cerca del núcleo, se los retiene con más fuerza y no se marcharán.
- Cuando el cloro gana un electrón, su tercer nivel de energía se completa. Un electrón adicional no se puede unir, porque debería ingresar al cuarto nivel de energía. A esta distancia del núcleo, el electrón no sentiría suficiente atracción por parte de los protones como para ser estable.
- Luego, el ion positivo de sodio y el ion negativo de cloro se atraen entre sí y forman un enlace iónico. Los iones son más estables cuando están enlazados, que como átomos individuales.
Paso 3
Haz que los alumnos describan el proceso de enlace iónico en el cloruro de sodio en su hoja de actividades.
Entrega a cada alumno una hoja de actividades.
Haz que los estudiantes escriban una leyenda breve debajo de cada imagen para describir el proceso de enlace covalente y que respondan las primeras tres preguntas. El resto de la hoja de actividades se deberá completar en conjunto con la clase, en grupos o individualmente, según tus instrucciones.
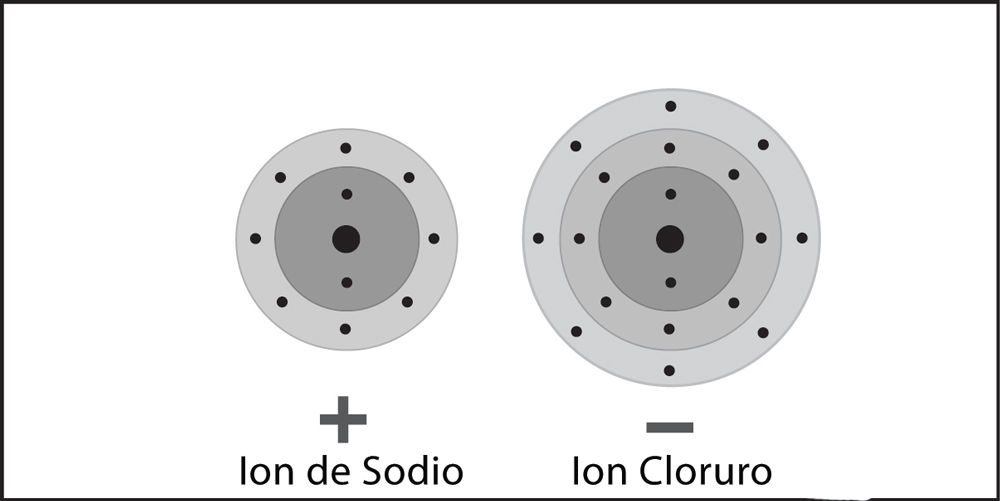
Proyecta la imagen Enlace iónico en el cloruro de sodio.
Revisa con los alumnos el proceso de enlace iónico visto en la animación.
Ayuda a los alumnos a escribir una leyenda breve al costado de cada imagen para describir el proceso de enlace iónico en los iones de sodio y cloro.
Paso 4
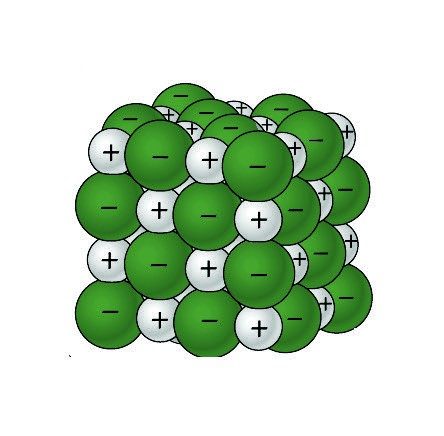
Muestra a los alumnos un modelo de cristal de cloruro de sodio e indica que identifiquen los iones.
Proyecta la imagen Cristal de cloruro de sodio.
Repasa con los alumnos el proceso de enlace iónico visto en la animación para que comprendan por qué los iones de sodio son positivos y los iones cloruro son negativos. Recuerda a los alumnos que la escala de cualquier modelo de átomos, iones o moléculas es enorme en comparación con el tamaño real. En un solo grano de sal hay miles de millones de iones de sodio y cloruro.
Pregunta a los alumnos:
- ¿Qué ion representa la esfera más grande con la carga negativa?
El ion cloruro. - ¿Qué hace que sea negativo?
Ganó un electrón. - ¿Cuál es el ion con la carga positiva?
El ion de sodio. - ¿Qué hace que sea positivo?
Perdió un electrón.
4 Explora
Paso 5
Pide a los alumnos que observen los cristales de cloruro de sodio reales y relacionen su forma con el modelo molecular.
Esta actividad de dos partes ayudará a los alumnos a ver la relación entre la disposición de los iones en un modelo de cristal de cloruro de sodio y la forma cúbica de los cristales reales de cloruro de sodio.
Pregunta para investigar:
¿Por qué los cristales de sal tienen forma de cubo?
Preparación del maestro
El día anterior a la lección, disuelve aproximadamente 10 gramos de sal en 50 ml de agua. Usa placas de Petri o corta con tijeras 5 o 6 vasos de plástico transparentes, para hacer placas de plástico poco profundas. Vierte suficiente agua salada para cubrir solo el fondo de cada plato (1 para cada grupo). Deja las placas durante la noche para evaporarlas, de modo que se produzcan nuevos cristales de sal.
Materiales para cada grupo
- Papel negro
- Sal
- Recipiente con sal a partir de agua salada evaporada
- Lupa
- Marcador permanente
Materiales para cada alumno
- 2 esferas de poliestireno pequeñas
- 2 esferas de poliestireno grandes
- 2 palillos de dientes
Procedimiento, Parte 1
Observar los cristales de cloruro de sodio.
- Coloca algunos granos de sal sobre un trozo de papel negro. Usa la lupa para observar la sal con detenimiento.
- Usa la lupa para ver los cristales de sal en el vaso.
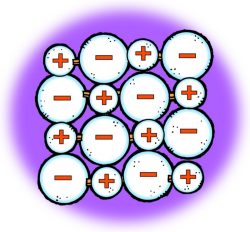
Proyecta la imagen Cloruro de sodio cúbico.
La imagen muestra una vista ampliada de la sal común de mesa y un modelo de los iones de sodio y cloruro que conforman un cristal de sal.
Proyecta la animación Cloruro de sodio.
Las esferas verdes representan iones cloruro con carga negativa y las esferas grises representan iones de sodio con carga positiva.
Pregunta a los alumnos:
- ¿Qué les dice la fotografía, el modelo molecular y sus observaciones de los cristales de sal reales sobre la estructura de la sal?
En cada caso, la sal parece tener forma de cubo.
Paso 6
Invita a los alumnos a construir un modelo tridimensional del cloruro de sodio.
Cada alumno fabricará 1 unidad de cloruro de sodio. Los alumnos de cada grupo reunirán sus unidades de cloruro de sodio.
Puedes ayudar a los grupos a combinar sus estructuras para formar un modelo de cristal de cloruro de sodio de toda la clase.

Procedimiento, Parte 2
Fabricar unidades de NaCl.
- Usa el marcador para colocar un “–” en las esferas grandes, que representan iones cloruro.
- Usa el marcador para colocar un “+” en las esferas pequeñas, que representan iones de sodio.
- Rompe dos palillos de dientes por la mitad. Usa una de las mitades de los palillos de dientes para conectar los centros de los iones grandes y pequeños para formar una unidad de cloruro de sodio (NaCl). Haz lo mismo con la otra esfera pequeña y grande.
- Usa otro medio palillo de dientes para conectar las dos unidades de NaCl en línea recta, como se muestra.
Une los iones de NaCl para formar una capa de iones. - Contribuye tu línea de iones al grupo y organízala para formar un cuadrado de 4 × 4 iones.
- Utiliza mitades de los palillos de dientes para unir los extremos de cada línea para mantener unidos a los iones. Solo debes colocar palillos de dientes en las esferas al final de cada línea.

Crea un cristal de cloruro de sodio para la clase
- Entrega a tu maestro la capa de iones de tu grupo. Tu maestro las apilará para construir un modelo de cristal de cloruro de sodio.

Señala que en cualquier parte del cristal se observa un ion de sodio y un ion cloruro, que siempre están rodeados por el ion con carga opuesta. Estas cargas opuestas mantienen a los iones unidos en un cristal.
Pregunta a los alumnos:
- Según la forma en que los iones de sodio y cloruro se unen, ¿por qué los cristales de sal tienen forma de cubo?
El tamaño y la disposición de los iones forman un cubo a nivel molecular. Dado que el patrón se repite una y otra vez de la misma manera, la forma permanece igual incluso cuando el cristal adquiere un tamaño normal que podemos ver.
5 Amplía
Paso 7
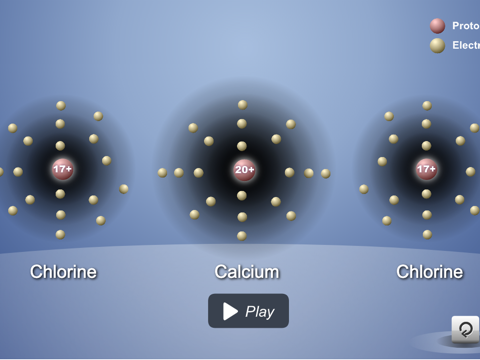
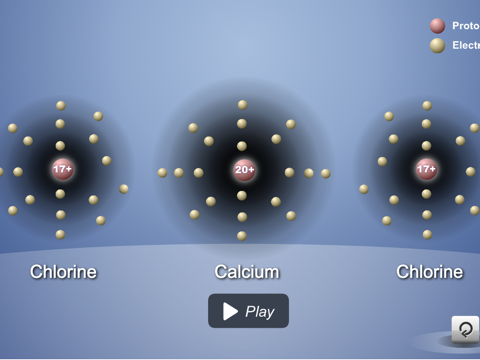
Muestra a los alumnos cómo los átomos de calcio y de cloro se unen para formar el compuesto iónico cloruro de calcio.
Diles a los alumnos que existe otra sustancia común llamada cloruro de calcio (CaCl2). Es la sal que se usa en veredas y carreteras heladas. Explica que, cuando el calcio y el cloro reaccionan, producen iones, como sodio y cloro, pero el ion de calcio es diferente del ion de sodio.
Pregunta a los alumnos:
- ¿De qué iones crees que está hecho el CaCl2?
Un ion de calcio y dos iones cloruro.
Proyecta la animación Enlace iónico del cloruro de calcio.
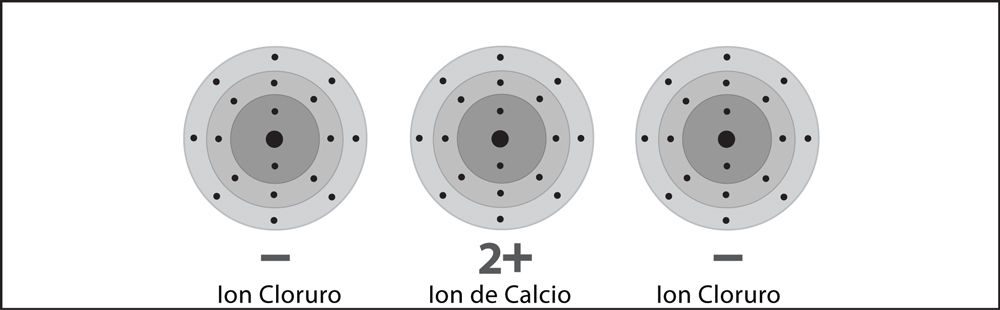
Señala que el calcio pierde dos electrones y se convierte en un ion +2. Cada uno de los dos átomos de cloro gana uno de estos electrones, lo que los convierte en un ion -1. Ayuda a los alumnos a darse cuenta de que 1 ion de calcio se enlaza con 2 iones cloruro para formar el cloruro de calcio (CaCl2), que es neutro.
Algunos átomos ganan o pierden más de 1 electrón. El calcio pierde 2 electrones al convertirse en un ion. Cuando los iones se unen para formar un enlace iónico, siempre se unen en números que cancelan exactamente la carga positiva y la negativa.
Proyecta la imagen Enlace iónico del cloruro de calcio.
Revisa con los alumnos el proceso de enlace iónico visto en la animación.
Invita a los alumnos a escribir una leyenda breve debajo de cada imagen para describir el proceso de enlace iónico en los iones de sodio y cloro.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Descargas
Para los estudiantes
- Lección 4.5 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 4.5 Plan de lección PDF | DOCX | Google Doc
- Lección 4.5 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
- Capítulo 4 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 4 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda