El dióxido de carbono puede volver ácida una solución
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- El gas dióxido de carbono (CO2) puede reaccionar con el agua para hacer ácida una solución.
- El exceso de dióxido de carbono en la atmósfera está haciendo que los océanos sean más ácidos.
Resumen
El maestro sopla en una solución indicadora de azul de bromotimol hasta que cambia de color de azul verdoso a amarillo. Los estudiantes interpretan este cambio de color y explican que la solución se vuelve ácida. Los estudiantes exploran si el dióxido de carbono de otras fuentes, como el agua carbonatada y una reacción química entre el bicarbonato de sodio y el vinagre, también pueden hacer que una solución sea ácida. Luego, los estudiantes observan una demostración del maestro que muestra que una vela encendida también produce el gas dióxido de carbono, que también vuelve ácida una solución. Los estudiantes aplican sus observaciones al problema ambiental de la acidificación de los océanos viendo un video e investigando este tema.
Objetivo
Los estudiantes podrán explicar que el dióxido de carbono de cualquier fuente reacciona químicamente con el agua para formar ácido carbónico. También podrán utilizar el cambio de color del indicador azul de bromotimol para identificar el cambio de pH de una solución durante una reacción química.

Seguridad
Asegúrese de que usted y los estudiantes usen gafas protectoras que le queden bien durante la actividad y que se laven las manos después. Use vinagre en una habitación bien ventilada. Lea y siga todas las advertencias de seguridad en la etiqueta. Deseche todos los residuos líquidos por el desagüe o de acuerdo con las regulaciones locales.
Materiales para las demostraciones
Demostración inicial
- Solución indicadora de azul de bromotimol
- Agua
- 2 vasos de plástico transparente
- Pajilla para beber (popote/ sorbete)
Demostración final
- 2 matraces de vidrio
- Vela de té
- Fósforo o encendedor
- Solución indicadora de azul de bromotimol
- Agua
- 2 vasos de plástico transparente
Materiales para cada grupo
- Agua
- Solución indicadora de azul de bromotimol en vaso
- Agua carbonatada (soda o agua mineral) en un vaso de plástico ancho y
- transparente.
- Bicarbonato de sodio en un vaso ancho y de plástico transparente
- Vinagre
- 2 vasos pequeños de plástico transparente
- 4 vasos anchos de plástico transparente
- 4 vasos de plástico transparentes más altos
- Cilindro graduado
Acerca de los materiales
Explique a los estudiantes que usarán un nuevo indicador para esta lección. El indicador se llama azul de bromotimol. Es de color verde azulado en agua corriente y se vuelve más verde amarillento a amarillo en un ácido.
- Tabla de colores del indicador universal de pH PDF
Descarga todos los recursos de la Lección 6.10
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 6.9: El dióxido de carbono puede volver ácida una solución."
Instrucciones
1 Involúcrate
Paso 1
Haga una demostración para mostrar que agregar gas CO2 al agua puede hacer que el agua se vuelva ácida.
Materiales para la demostración
- Solución indicadora de azul de bromotimol
- Agua
- 2 vasos de plástico transparente
- Pajilla para beber (popote/ sorbete)
Preparación del maestro
Hacer solución indicadora
Necesitará unos 100 mL de solución indicadora para sus demostraciones. Utilice 100 mL de agua con aproximadamente 4-5 mL de azul de bromotimol. En las actividades, cada grupo necesitará alrededor de 80 mL de solución indicadora. Prepare la solución indicadora de los estudiantes en una proporción similar a la suya y vierta al menos 80 mL de esta solución indicadora diluida en un vaso de plástico limpio para cada grupo de estudiantes.
Nota: Es probable que el agua del grifo local sea adecuada para las demostraciones y actividades de esta lección. Técnicamente, el azul de bromotimol es verde en agua con pH neutro. La solución indicadora que prepare puede ser verde, azul verdoso o azul según el pH del agua del grifo. Cualquiera de estos colores funcionará en las demostraciones y experimentos. A los efectos de esta lección, mostraremos la solución de azul de bromotimol en color azul verdoso en agua del grifo. Si su solución de azul de bromotimol no es verde, azul verdoso o azul, puede usar agua destilada que está disponible en supermercados y farmacias.
Prepárese para la demostración
Vierta aproximadamente 25 mL de solución indicadora en cada uno de los dos vasos de plástico transparente para utilizarlos en la demostración.

Procedimiento
- Muestre a los estudiantes ambas muestras de solución indicadora. Coloque una pajilla en una de las muestras de modo que llegue hasta el fondo del vaso.
- Sostenga el vaso de manera que los estudiantes puedan ver claramente el líquido. Sople en la pajilla hasta que la solución indicadora cambie de azul verdoso a amarillo.
Pregunta a los estudiantes:
- ¿Soplar en la solución indicadora cambia su pH?
Sí, el color cambia, por lo que también debe haber un cambio en el pH. - ¿La solución se vuelve un poco más ácida o un poco más básica?
El cambio de color muestra que la solución es un poco más ácida.
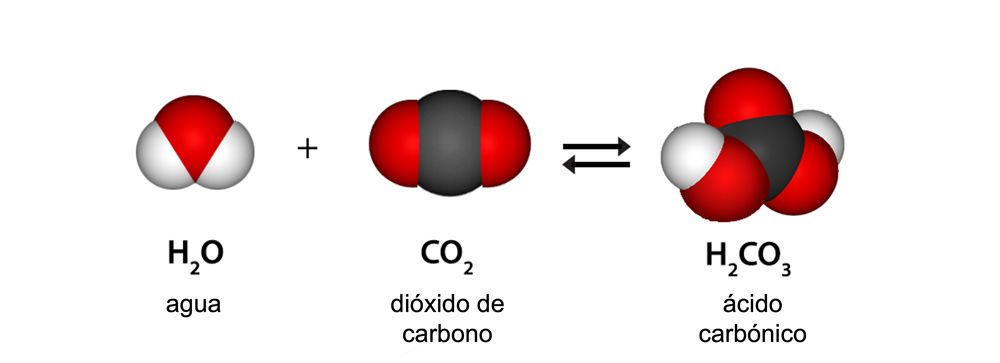
Dígales a los estudiantes que ocurre una reacción química entre las moléculas de dióxido de carbono (CO2) y las moléculas de agua (H2O) para crear una cantidad muy pequeña de un ácido llamado ácido carbónico (H2CO3).
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 6.10 Hoja de actividades PDF | DOCX | Google Doc
- Lección 6.10 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
Descargue la hoja de actividades del estudiante y distribuya una por estudiante cuando se especifique en la actividad. La hoja de actividades servirá como componente de “Evaluación” de cada plan de lección 5-E.
Los estudiantes registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y llévalo más lejos de la hoja de actividades se completarán como clase, en grupos o individualmente, según sus instrucciones. Para encontrar las respuestas a la hoja de actividades, vaya al área de descargas dentro de la versión en línea de esta lección.
3 Explora
Paso 2
Haga que los estudiantes usen agua carbonatada como fuente de CO2 para ver si el gas cambiará el pH de una solución indicadora.
Pregunta para investigar
¿El dióxido de carbono del agua carbonatada cambiará el pH de una solución indicadora?
Materiales para cada grupo
- Solución indicadora de azul de bromotimol en un vaso de plástico
- Agua
- Agua carbonatada (soda o agua mineral) en un vaso ancho de plástico transparente.
- 1 vaso de plástico transparente y ancho
- 2 vasos de plástico transparentes más altos
- Cilindro graduado
Preparación del maestro
Vierta 25 mL de agua carbonatada en un vaso de plástico transparente y ancho para cada grupo.

Procedimiento
- Mida 30 mL de solución indicadora y divídalo uniformemente en dos vasos pequeños de plástico transparente.
- Agregue 25 mL de agua a un vaso de plástico ancho y 25 mL de agua carbonatada a otro vaso ancho.
- Coloque los vasos pequeños con la solución indicadora en el líquido de los vasos más anchos, como se muestra.
- Voltee los dos vasos altos vela y colóquelas sobre los dos vasos más anchos.

- Mientras sostiene los vasos superior e inferior para mantenerlos juntos, gire suavemente ambos juegos de vasos. Observe el color del indicador en ambos vasos para ver si hay algún cambio.
- Compare el color del indicador en ambos vasos.
Resultados esperados
El indicador dentro de los vasos con agua permaneció azul verdoso, mientras que el indicador con agua carbonatada se volvió amarillo.
Paso 3
Discuta las observaciones de los estudiantes y lo que sucederá en la siguiente actividad.
Pregunte a los estudiantes:
- ¿Alguno de los indicadores cambió de color?
Sólo el indicador con el agua carbonatada cambió de color. - ¿Qué te dice el cambio de color sobre el pH de la solución indicadora? ¿Es ácido o básico?
La solución indicadora ahora es ácida. - El agua carbonatada no debería haber salpicado el indicador. ¿Por qué la solución indicadora cambió de color en un juego de vasos?
El dióxido de carbono del agua carbonatada se disolvió en la solución indicadora. Las moléculas de dióxido de carbono reaccionaron con el agua formando ácido carbónico y cambiaron el color del indicador.
Dígales a los estudiantes que han visto cómo el gas dióxido de carbono del aliento y el gas dióxido de carbono del agua carbonatada vuelven ácida una solución indicadora.
Pregunte a los estudiantes:
- ¿Crees que el dióxido de carbono producido durante una reacción química también volverá ácida una solución indicadora?
El dióxido de carbono de cualquier fuente debería hacer que la solución indicadora se vuelva ácida. La cantidad de dióxido de carbono producido y disuelto en la solución indicadora puede hacer que el color del indicador varíe, pero en el lado ácido. - ¿Qué reacción química conoces que pueda producir gas dióxido de carbono?
Los estudiantes deben recordar que el vinagre y el bicarbonato de sodio reaccionan y producen dióxido de carbono. Dígales a los estudiantes que combinarán bicarbonato de sodio y vinagre en la siguiente actividad.
Paso 4
Utilice una reacción química para producir CO2 y ver si cambia el pH de una solución indicadora.
Pregunta para investigar
El dióxido de carbono producido en la reacción del bicarbonato de sodio y el vinagre cambiará el pH de una solución indicadora?
Materiales para cada grupo
- Solución indicadora de azul de bromotimol en vaso
- Agua
- Bicarbonato de sodio en un vaso pequeño de plástico
- Vinagre en vaso
- 2 vasos pequeños de plástico transparente
- 1 vaso ancho de plástico transparente
- 2 vasos de plástico transparente más altos
- Cilindro graduado
Preparación del maestro
- Vierta unos 50 mL de vinagre en un vaso de plástico ancho para cada grupo.
- Coloque aproximadamente ½ cucharadita de bicarbonato de sodio en un vaso pequeño de plástico transparente para cada grupo.
Procedimiento
- Mida y vierta 25 mL de vinagre en dos vasos de plástico anchos.
- Vierta 15 mL de indicador azul de bromotimol en dos vasos de plástico pequeños y limpios.
- Vierta todo el bicarbonato de sodio en uno de los vasos de vinagre. No viertas nada en el otro.
- Coloque los vasos pequeños con la solución indicadora en ambos vasos más anchos, como se muestra.

- Voltee los dos vasos altos y colóquelos sobre los dos vasos más anchos.
- Mientras sostiene los vasos superior e inferior para mantenerlos juntos, gire suavemente ambos juegos de vasos. Observe el color del indicador en ambos vasos algún cambio.
- Compare el color del indicador en cada vaso para saber si la solución es ácida, neutra o básica.
Resultados esperados
El indicador dentro del vaso con solo vinagre permaneció azul verdoso, mientras que el indicador dentro del vaso con la reacción de vinagre y bicarbonato de sodio se volvió amarillo.
Paso 5
Discuta las observaciones de los estudiantes.
Pregunte a los estudiantes:
- ¿Alguno de los indicadores cambió de color?
Sólo el indicador con la reacción química cambió de color. - ¿Por qué un juego de vasos solo tenía vinagre en el fondo?
Es posible que el vinagre por sí solo haga que el indicador cambie de color. Dado que este indicador no cambió de color, debe ser el gas dióxido de carbono producido por la reacción química, y no solo el vinagre, el que provocó el cambio de color. La solución indicadora del juego de vasos con solo vinagre en el fondo sirve como control. - ¿Qué te dice el color de la solución indicadora sobre el pH de cada solución? ¿Es ácido, neutro o básico?
El cambio de color muestra que la solución indicadora es ácida.
Paso 6
Demuestre que el dióxido de carbono de la llama de una vela también acidifica el agua.
Materiales para la demostración
- Vela de té
- Fósforos o encendedor
- 2 vasos pequeños de plástico transparente
- 2 frascos de vidrio lo suficientemente grandes como para colocarlos
- sobre la vela
- Agua
- Indicador azul de bromotimol
Seguridad
Asegúrese de que usted y los estudiantes usen gafas protectoras que le queden bien. Tenga cuidado al encender la vela. Asegúrese de que el fósforo y la vela estén completamente apagados cuando termine la demostración.
Preparación del maestro
Si no tiene ninguna solución indicadora diluida, prepare una agregando aproximadamente 3 mL de indicador azul de bromotimol a 50 mL de agua. Divida la solución indicadora diluida en partes iguales en dos vasos pequeños.
Nota
Después de sostener el matraz sobre la vela durante aproximadamente 10 segundos, se agregará una solución indicadora de azul de bromotimol diluida al matraz que estaba sobre la vela y a otro matraz como control. Se agitan ambos matraces. El indicador reaccionará con el dióxido de carbono en el matraz que estaba sobre la vela, pero no reaccionará en el otro matraz. Esto indica que la vela produjo dióxido de carbono que acidificó la solución.

Procedimiento
- Encienda con cuidado una vela de té.
- Tenga 2 matraces disponibles. Sostenga un matraz sobre la vela como se muestra.
- Manténgalo ahí durante unos 10 segundos y luego dé la vuelta al matraz.
- Vierta con cuidado unos 25 mL de solución indicadora de azul de bromotimol en ambos matraces y agite ambos.
Resultados esperados
El indicador cambiará de color de azul verdoso a amarillo en el matraz que estaba sobre la vela.
Paso 7
Tenga una discusión en clase sobre qué gas probablemente produjo la llama.
Pregunte a los estudiantes:
- ¿Qué gas probablemente produjo la llama y cómo lo sabes?
La llama probablemente produjo dióxido de carbono porque reaccionó de la misma manera con la solución indicadora que las otras muestras de dióxido de carbono.
4 Explica
Paso 8
Explique que el dióxido de carbono de cualquier fuente puede acidificar el agua.
Pregunte a los estudiantes:
- ¿Qué efecto tienen en el agua el dióxido de carbono del aliento, el agua carbonatada y la reacción del bicarbonato de sodio y el vinagre?
El CO2 de cada fuente reaccionó con el agua y la volvió ácida.
Proyecte la ilustración CO2 Reaccionando con el Agua.
Dígales a los estudiantes que el dióxido de carbono reacciona con el agua para producir ácido carbónico. Los estudiantes pueden contar el número de átomos en cada lado de la ecuación para demostrar que está equilibrada. Señale que la doble flecha en esta ecuación significa que el ácido carbónico se descompone fácilmente para formar nuevamente dióxido de carbono y agua.
Explique a los estudiantes que demasiado CO2 en la atmósfera hace que la Tierra y su atmósfera se calienten. Pero el exceso de CO2 puede provocar algo más, como han visto en la ecuación química y en sus experimentos. El dióxido de carbono puede hacer que el agua sea más ácida, lo que está provocando un gran problema en los océanos. El exceso de ácido en el agua del océano, llamado acidificación del océano, dificulta que algunos organismos formen conchas y es especialmente dañino para los corales.
5 Amplía
Paso 9
Explique cómo la acidificación de los océanos es mala para los organismos que forman conchas y muestre un video sobre la acidificación de los océanos.
Explique que el océano es realmente básico. El pH del océano es de aproximadamente 8.2. El término "acidificación del océano" significa que el océano tiende a volverse más ácido o menos básico. Ha pasado de aproximadamente 8.2 a 8.1. Puede que esto no parezca un gran cambio, pero es un cambio muy grande para los organismos del océano que son muy sensibles a los cambios de pH. Cuando el agua del océano se vuelve más ácida, causa dos problemas principales para los organismos que fabrican conchas, como las almejas, las ostras y los corales:
- A estos organismos les resulta más difícil fabricar sus caparazones.
- Durante muchos años, si el agua se vuelve demasiado ácida, las conchas delicadas pueden reaccionar con el agua más ácida y provocar que se rompan.
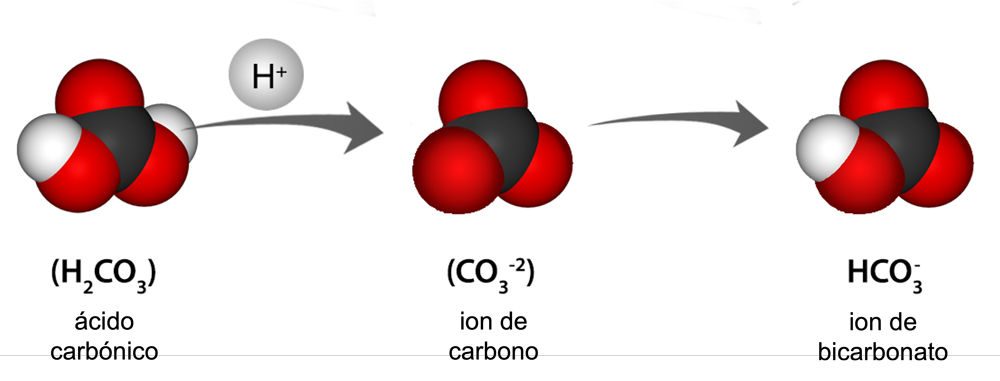
Las almejas, las ostras, los corales y otros organismos que fabrican conchas las forman a partir de dos iones: el ion calcio (Ca+2) y el ion carbonato (CO-2). Cuando estos dos iones se unen, producen carbonato de calcio (CaCO3), que es la sustancia principal de la estructura de la capa. La acidificación de los océanos afecta al ion carbonato. Así es cómo:
Proyecte la ilustración ácido carbónico e ion carbonato.
Recuerde a los estudiantes que el agua y el dióxido de carbono reaccionan para formar ácido carbónico.
Un átomo de hidrógeno procedente del ácido carbónico pasa al agua en forma de ion hidrógeno (H+). Este ion hidrógeno se une al ion carbonato en el agua del océano y crea un ion bicarbonato (HCO3-) que los organismos que fabrican conchas no pueden utilizar. Esto significa que hay menos iones de carbonato a los que las criaturas pueden unir un ion de calcio, lo que les dificulta producir el carbonato de calcio que necesitan para formar sus caparazones.
Los iones de hidrógeno adicionales en el agua también la hacen más ácida. Si el agua eventualmente se vuelve demasiado ácida, podría reaccionar con el carbonato de calcio de las cáscaras, provocando que se descompongan.
Muestre el vídeo Acidificación de los Océanos.
Nota: La narración y la acción del video transcurren bastante rápido, por lo que es posible que desee detener el video en algunos lugares para ayudar a los estudiantes a comprender lo que se presenta.

Los puntos verdes representan el exceso de dióxido de carbono en la atmósfera debido a la quema de combustibles fósiles. El océano absorbe una gran cantidad de este dióxido de carbono.

Los pequeños caracteres naranjas representan iones de carbonato que necesitan los organismos formadores de conchas. Utilizan iones de carbonato e iones de calcio para producir carbonato de calcio para construir sus caparazones.

El dióxido de carbono reacciona con el agua y produce ácido carbónico (una mancha verde irregular) que produce iones de hidrógeno. Estos iones se unen a los iones carbonato y crean una sustancia (no se muestra el ion bicarbonato) que los organismos no pueden usar.

Como las conchas son difíciles de fabricar, las almejas y otros organismos que fabrican conchas serán más pequeños y no se reproducirán tanto, por lo que las criaturas que las coman pueden no obtener suficiente alimento. Esto podría afectar a toda la cadena alimentaria.

Los iones de hidrógeno adicionales no sólo se unen al ion carbonato, sino que también hacen que el agua sea más ácida.

Los océanos podrían volverse tan ácidos en el futuro que las capas de carbonato de calcio podrían reaccionar con el agua y descomponerse.
Paso 10
Haga que los estudiantes investiguen formas de reducir la cantidad de dióxido de carbono liberado a la atmósfera.
La gran mayoría del exceso de dióxido de carbono en la atmósfera de la Tierra proviene de la quema de combustibles fósiles como petróleo, gas natural y carbón. La mayor parte de este combustible se utiliza en automóviles, camiones y otros medios de transporte, en el funcionamiento de centrales eléctricas que producen electricidad y en la calefacción de hogares y empresas.
Haga que los estudiantes investiguen fuentes alternativas de energía que podrían ayudar a quemar menos combustibles fósiles. Los estudiantes pueden presentar su investigación en un documento breve con ilustraciones, PowerPoint, tablero tríptico o de cualquier forma que crean que funcionará. Los estudiantes deben describir cómo funciona la fuente de energía renovable y las ventajas y desafíos de la tecnología.
Algunos posibles temas podrían ser:
Fuentes de energía renovable
- Viento
- Solar
- Geotérmica
- Biocombustibles
- Hidroeléctrico
Nueva tecnología de transporte
- Autos eléctricos
- Celdas de combustible de hidrógeno
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Descargas
Para los estudiantes
- Lección 6.10 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 6.10 Plan de lección PDF | DOCX | Google Doc
- Lección 6.10 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Recursos para el Capítulo 6
- Capítulo 6 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 6 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda