¿Por qué el agua disuelve el azúcar?
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- Para que un líquido disuelva un sólido, las moléculas del líquido y del sólido deben atraerse entre sí.
- El enlace entre los átomos de oxígeno e hidrógeno (enlace O–H) en el azúcar (sacarosa) da al oxígeno una carga ligeramente negativa y al hidrógeno una carga ligeramente positiva. La sacarosa es una molécula polar.
- Las moléculas de agua polares atraen las áreas negativa y positiva de las moléculas de sacarosa polares, lo que hace que la sacarosa se disuelva en agua.
- Una sustancia apolar como el aceite mineral no disuelve una sustancia polar como la sacarosa.
Resumen
Los alumnos observarán la disolución del recubrimiento de azúcar de un M&M cuando se lo coloca en agua. A continuación, los alumnos ayudarán a diseñar un experimento para ver si el tipo de líquido en el que se coloca el M&M afecta la cantidad de recubrimiento que se disuelve.
Objetivo
Los alumnos podrán explicar, a nivel molecular, cómo interactúan las características polares del agua y el azúcar para que el agua disuelva el azúcar. Los alumnos podrán identificar y controlar las variables en su experimento. Los alumnos también podrán explicar por qué un líquido apolar, como el aceite mineral, no disuelve bien el azúcar.

Safety
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas. El alcohol isopropílico es inflamable. Mantenlo alejado de cualquier llama o fuente de chispa. Lee y sigue todas las advertencias de la etiqueta. Desecha el alcohol isopropílico y el aceite mineral de acuerdo con la normativa local. Avisa a los alumnos que no coman los M&M. Pide a los alumnos que se laven las manos después de la actividad.
Materiales para cada grupo
- M&M
- Agua
- Aceite mineral
- Alcohol isopropílico (al 70 %)
- Placa pequeña de plástico blanca
- 3 vasos de plástico transparente
- Papel blanco
Descarga todos los recursos de la Lección 5.4
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 5.4: ¿Por qué el agua disuelve el azúcar?"
Instrucciones
1 Involúcrate
Paso 1
Ayuda a los alumnos a darse cuenta de que el recubrimiento de azúcar de un M&M está hecho principalmente de azúcar y un poco de colorante.
Reparte los M&M a los alumnos y pídeles que miren el recubrimiento exterior de azúcar. A continuación, haz que los alumnos rompan un M&M para examinar atentamente el recubrimiento desde el interior.
Pregunta a los alumnos:
- ¿De qué creen que está hecho el recubrimiento de un M&M?
Los alumnos verán la capa de color con una capa blanca debajo y sugerirán que el recubrimiento está hecho de azúcar y colorante. Explica que el recubrimiento es principalmente azúcar. - ¿Alguna vez han notado lo que sucede con el recubrimiento de un M&M cuando se humedece?
Se desprende el colorante y, si se humedece lo suficiente, se desprende toda la capa, dejando solo el chocolate.
Diles a los alumnos que en esta actividad, verán lo que sucede con el recubrimiento de azúcar y colorante de un M&M cuando se lo coloca en agua.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 5.4 Hoja de actividades PDF | DOCX | Google Doc
- Lección 5.4 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Observa la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explora
Paso 2
Pide a los alumnos que coloquen un M&M en un vaso de agua y observen.
Pregunta para investigar
¿Qué sucede con el recubrimiento de azúcar y colorante de un M&M cuando se lo coloca en agua?
Materiales
- Vaso de plástico transparente
- Agua
- M&M
- Papel blanco

Procedimiento
- Vierte suficiente agua a temperatura ambiente en un vaso de plástico transparente de modo que el agua cubra completamente un M&M, y coloca ese vaso sobre un trozo de papel blanco.
- Una vez que el agua esté quieta, coloca 1 M&M en el centro del vaso. Ten cuidado de mantener el agua y los M&M lo más quietos posible. Observa durante aproximadamente 1 minuto.
Resultados esperados
El recubrimiento del M&M se disolverá, revelando una capa blanca bajo el color y luego el chocolate marrón por debajo. El recubrimiento de color de los M&M se acumulará en un patrón circular alrededor del M&M. Los alumnos también pueden mencionar las manchas blancas en el agua del recubrimiento de azúcar.
Paso 3
Analiza las observaciones de los alumnos.
Pregunta a los alumnos:
- ¿Qué notan sobre el M&M y el agua?
El color se desprende y se desplaza por el agua siguiendo un patrón circular. - ¿Qué creen que ocurre cuando el colorante y el azúcar se desprenden del M&M?
Señala a los alumnos que, debido a que el agua hace que el recubrimiento de color se desprenda del M&M y se mezcle con el agua, el agua está disolviendo el azúcar y el colorante.
Nota: En realidad, en esta actividad hay dos procesos. El colorante y el azúcar se disuelven en el agua, pero también se disipan. Para centrarse en la cantidad que se disuelve a partir de un M&M, los alumnos deben observar la cantidad de recubrimiento que falta del M&M, en lugar del tamaño del círculo de color en el agua.
- Sabiendo lo que sabes sobre la polaridad del agua, ¿por qué crees que el agua disuelve el azúcar?
Los alumnos pueden pensar que el azúcar está hecho de enlaces iónicos como la sal. O pueden pensar que el azúcar tiene áreas positivas y negativas, y por eso el agua se ve atraída a él.
4 Explica
Paso 4
Muestra a los alumnos cómo las áreas polares de una molécula de sacarosa hacen que esta se disuelva en agua.
Explica a los alumnos que el azúcar está formada por moléculas grandes llamadas sacarosa. Cada molécula de sacarosa está formada por átomos con enlaces covalentes.
Pregunta a los alumnos:
- La fórmula química de la sacarosa es C12H22O11. ¿Qué significan estas letras y números?
La sacarosa está compuesta por 12 átomos de carbono, 22 átomos de hidrógeno y 11 átomos de oxígeno.
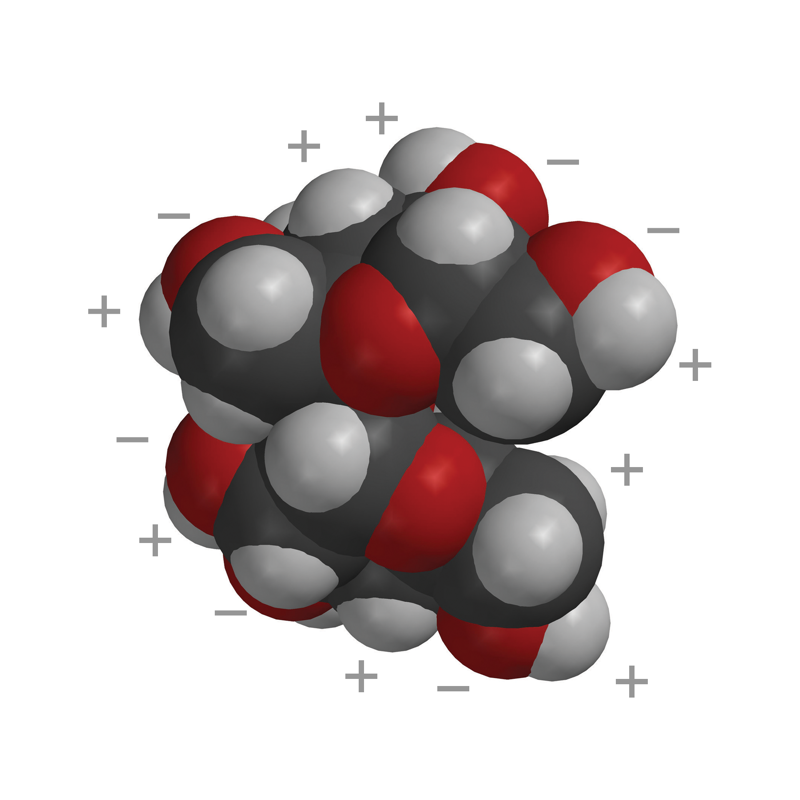
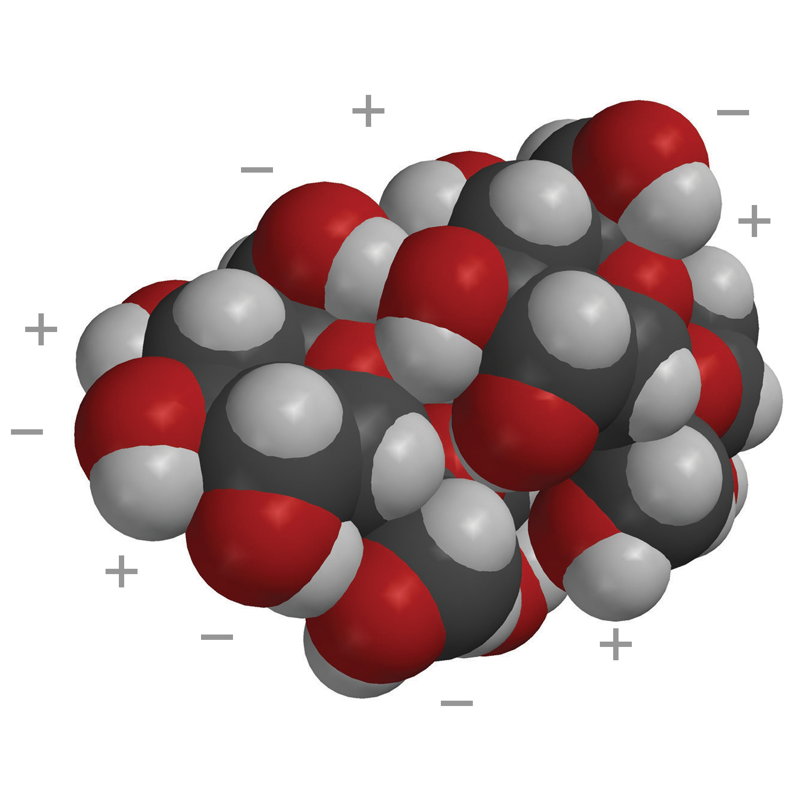
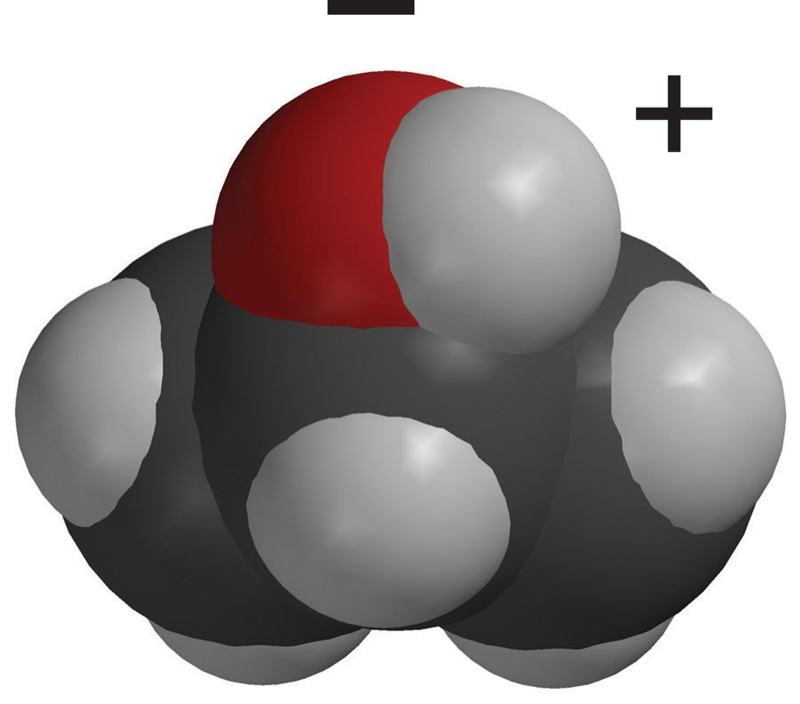
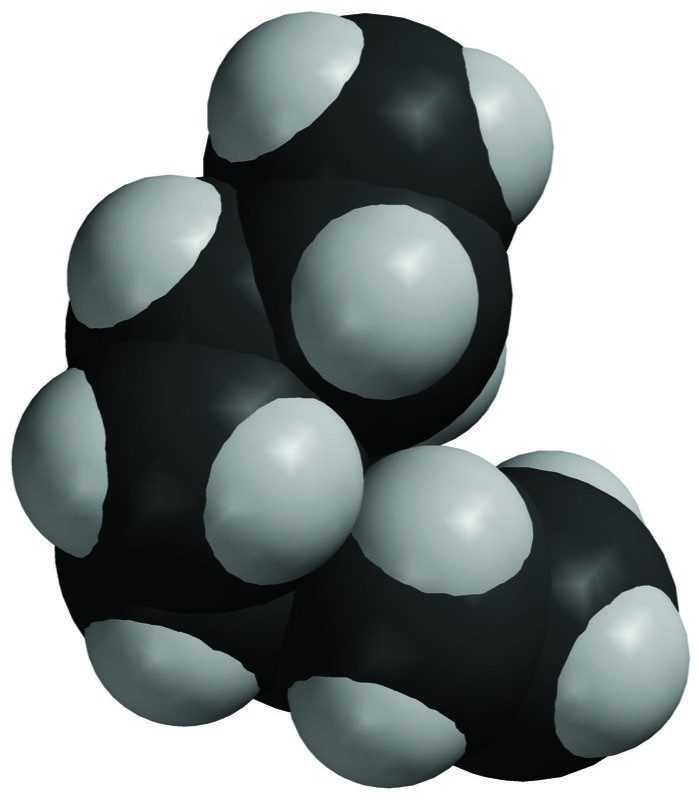
Proyecta la imagen Sacarosa.
Explica que la primera imagen es un modelo de barras y esferas de una única molécula de sacarosa. La siguiente imagen es un modelo espacial de una única molécula de sacarosa. La última imagen son dos moléculas de sacarosa atraídas entre sí. Estas dos moléculas se separan entre sí cuando se disuelve el azúcar. Señala que en las áreas de una molécula de sacarosa donde el oxígeno se une al hidrógeno (enlace O–H), el oxígeno es ligeramente negativo y el hidrógeno es ligeramente positivo. Esto hace de la sacarosa una molécula polar.
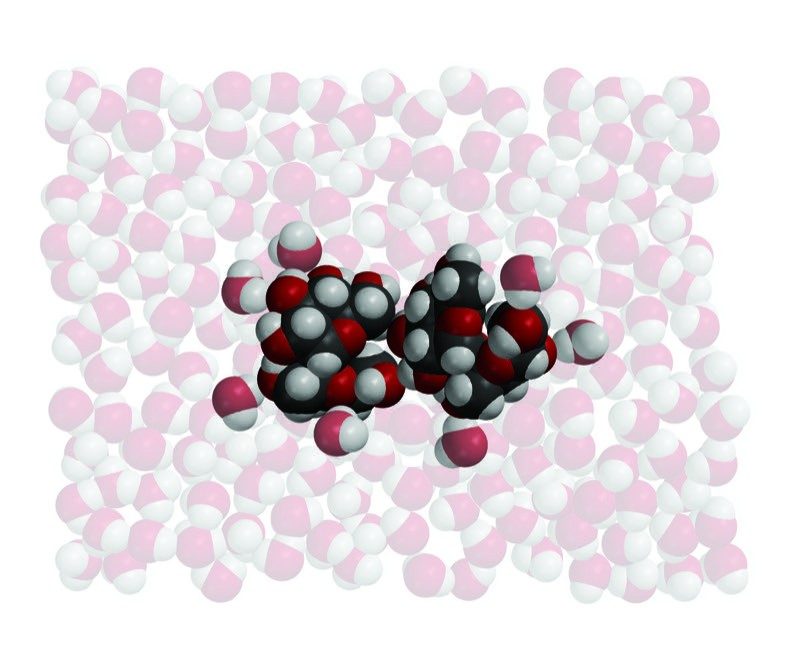
Proyecta la imagen El agua disuelve la sacarosa.
Explica que un terrón de azúcar (aproximadamente media cucharadita de azúcar) está compuesto por al menos mil millones de moléculas de sacarosa. Cuando el azúcar se disuelve, estas moléculas de sacarosa enteras se separan entre sí. La molécula en sí no se rompe: Los átomos que componen cada molécula permanecen juntos para formar la molécula de sacarosa.
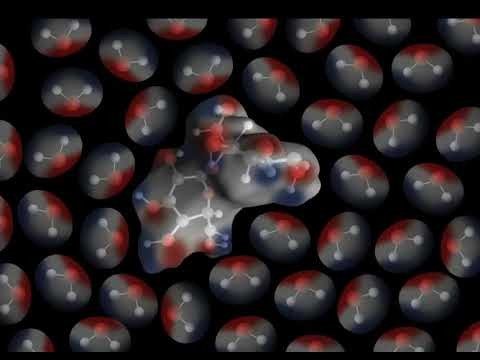
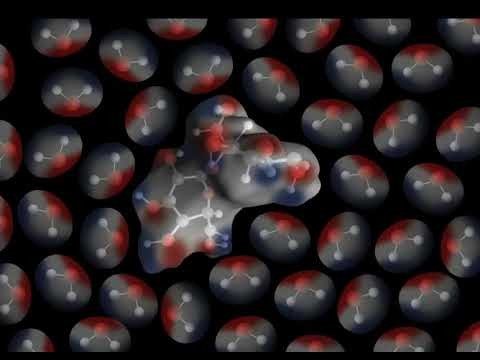
Proyecta la animación Sacarosa.
Explica que la sacarosa tiene áreas polares causadas por el mismo tipo de enlaces covalentes de oxígeno-hidrógeno que en la molécula de agua. Señala los enlaces O–H en los bordes exteriores de la molécula. Señala que la unión del oxígeno y el hidrógeno en la sacarosa hace que algunas partes de la molécula de sacarosa polar sean similares a las de una molécula de agua. El área cercana al hidrógeno es positiva (azul) y el área cercana al oxígeno es negativa (rojo).
Proyecta la animación El agua disuelve la sacarosa.
Diles a los alumnos que las moléculas de azúcar se atraen entre sí y se mantienen unidas por la atracción entre estas áreas polares de las moléculas.
Ayuda a los alumnos a observar cómo se ve atraída el área positiva (azul) de una molécula de agua al área negativa (rojo) de una molécula de sacarosa. Esto también funciona al revés. Ayuda a los alumnos a observar cómo se ve atraída el área negativa (rojo) de una molécula de agua al área positiva (azul) de la molécula de sacarosa.
Explica que las áreas positiva y negativa de las moléculas de agua interactúan con estas partes negativa y positiva de las moléculas de sacarosa. Cuando la atracción entre las moléculas de agua y las moléculas de sacarosa supera la atracción que las moléculas de sacarosa experimentan con respecto a otras moléculas de sacarosa, se separan las unas de las otras y se disuelven.
Señala que una molécula de sacarosa entera se desprende de otra molécula de sacarosa entera. La molécula en sí no se separa en átomos individuales.
Nota: Aunque el objetivo es la disolución de las moléculas de azúcar polar, el colorante de alimentos utilizado para colorear los M&M también está hecho de moléculas polares. Esto ayuda a explicar por qué también se disuelve el colorante.
5 Explora
Paso 5
Pide a los alumnos que realicen un experimento para comparar cómo el agua, el alcohol y el aceite disuelven el azúcar y el recubrimiento de color de un M&M.
Pide a los alumnos que hagan una predicción:
¿Creen que el agua, el alcohol o el aceite funcionarán mejor para disolver el recubrimiento de azúcar y colorante de un M&M?
Comenta con los alumnos cómo diseñar un experimento para comparar cómo el agua, el alcohol y el aceite vegetal disuelven el recubrimiento de colorante y azúcar de un M&M. Asegúrate de que los alumnos identifiquen variables como:
- Cantidad de agua, alcohol y aceite utilizada
- Temperatura de cada líquido
- Mismo color de los M&M
- Momento y ubicación en los que se colocan los M&M en cada líquido
Pregunta para investigar
¿Cuál es mejor, el agua, el alcohol o el aceite para disolver el recubrimiento de colorante y azúcar de un M&M?
Materiales
- 3 M&M (del mismo color)
- Agua
- Aceite mineral
- Alcohol isopropílico (al 70 %)
- 3 vasos de plástico transparente
- Papel blanco

Procedimiento
- Etiqueta 3 vasos para que digan “Agua”, “Alcohol” y “Aceite”. Añade 15 ml de agua, alcohol y aceite mineral a los vasos etiquetados.
- Coloca los tres vasos sobre un papel blanco.
- Al mismo tiempo, añade 1 M&M a cada líquido. A continuación, agita suavemente el líquido y el M&M de cada vaso durante unos 30 segundos.
Resultados esperados
Agua: el azúcar y el colorante se disuelven del M&M.
Alcohol: el colorante se disuelve solo ligeramente y el recubrimiento de azúcar parece no disolverse.
Aceite: ni el colorante ni el azúcar se disuelven.
6 Explica
Paso 6
Muestra a los alumnos las estructuras moleculares del agua, el alcohol y el aceite y habla de cómo se relaciona esto con sus observaciones.
Proyecta la imagen Polaridad del agua, el alcohol y el aceite.
Muestra a los alumnos las áreas polares de una molécula de agua, una molécula de alcohol isopropílico y una molécula de aceite.
Agua
Las moléculas de agua son polares. El agua polar disuelve el colorante polar y el azúcar polar.
Alcohol isopropílico (al 70 %)
El alcohol es un 30 % de agua y un 70 % de alcohol, y no es un buen disolvente. Las moléculas de alcohol solo tienen un área polar y también un área apolar más grande. Esto hace que el alcohol no sea un buen disolvente de las sustancias polares. Además, el agua y el alcohol interactúan, lo que significa que el agua ni siquiera disuelve el azúcar o el colorante tan bien como lo haría normalmente.
Aceite
Las moléculas de aceite no son polares, por lo que no pueden disolver ni el colorante ni el azúcar.
7 Amplía
Paso 7
Muestra a los alumnos las estructuras moleculares del agua, el alcohol y el aceite y habla de cómo se relaciona esto con sus observaciones.
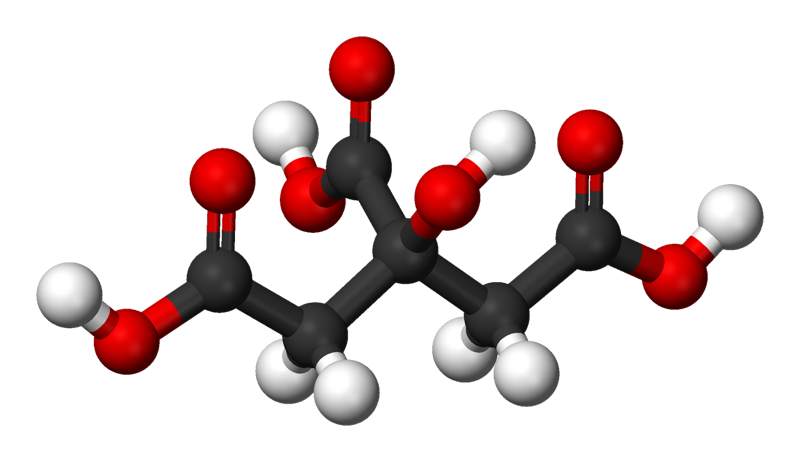
Proyecta la imagen Ácido cítrico.
Explica que la imagen proyectada es un modelo de una molécula de ácido cítrico. Diles a los alumnos que el ácido cítrico es la sustancia que da a los limones, las limas, los pomelos y las naranjas su sabor ácido. El ácido cítrico es muy soluble en agua y se disuelve en el agua de la fruta.
Pregunta a los alumnos:
- ¿Por qué creen que el ácido cítrico es tan soluble en agua? PISTA: La fórmula química del ácido cítrico es C6H8O7.
En cada lugar en el que hay un enlace O–H, hay un intercambio desigual de electrones. Los átomos de oxígeno de un enlace O–H tienen una carga ligeramente negativa y los átomos de hidrógeno del enlace tienen una carga ligeramente positiva.
Debido a que las moléculas de agua también son polares, los extremos positivos de las moléculas de agua se ven atraídos por las áreas de carga negativa de las moléculas de ácido cítrico. Los extremos negativos de las moléculas de agua se ven atraídos por las áreas positivas de las moléculas de ácido cítrico. Estas atracciones mutuas superarán las atracciones que experimentan las moléculas de ácido cítrico con respecto a otras moléculas de ácido cítrico, lo que hará que se mezclen bien en el agua y se disuelvan.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Descargas
Para los estudiantes
- Lección 5.4 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 5.4 Plan de lección PDF | DOCX | Google Doc
- Lección 5.4 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Recursos para el Capítulo 5
- Capítulo 5 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 5 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda