Cambios energéticos en las reacciones químicas
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- Si dos sustancias reaccionan y la temperatura de la mezcla disminuye, la reacción es endotérmica.
- Si dos sustancias reaccionan y la temperatura de la mezcla aumenta, la reacción es exotérmica.
- Una reacción química implica la rotura de enlaces en los reactivos y la formación de enlaces en los productos.
- Se necesita energía para romper un enlace.
- Se libera energía cuando se forman un enlace.
- Si una reacción es endotérmica, se necesita más energía para romper los enlaces de los reactivos que la que se libera cuando se forman los enlaces de los productos.
- Si una reacción es exotérmica, se libera más energía cuando se forman los enlaces de los productos que la necesaria para romper los enlaces de los reactivos.
Resumen
Los alumnos realizarán dos reacciones químicas. En la primera, la temperatura bajará (endotérmica) y en la segunda, la temperatura aumentará (exotérmica). Los alumnos verán una animación para repasar un concepto que se presentó en el Capítulo 5: que se requiere energía para romper los enlaces y que se libera energía cuando se forman nuevos enlaces. Los alumnos utilizarán esta idea para explicar por qué una reacción es endotérmica o exotérmica.
Objetivo
Los alumnos serán capaces de definir una reacción endotérmica y exotérmica. Los alumnos podrán utilizar el concepto de energía en la ruptura y la creación de enlaces para explicar por qué una reacción puede ser endotérmica y otra reacción puede ser exotérmica.

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas.
Materiales para cada grupo
- Vinagre
- Bicarbonato
- Cloruro de calcio
- Agua
- Termómetro
- 4 vasos pequeños
- Calentador de manos de autocalentamiento desechable
- Globo de inflado automático
Materiales adicionales si decide hacer la extensión adicional
- Sulfato de magnesio
- Carbonato de sodio
- Ácido cítrico
- Indicador universal
Descarga todos los recursos de la Lección 6.7
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 6.7 - Cambios energéticos en las reacciones químicas."
Instrucciones
1 Involúcrate
Paso 1
Comenta los cambios de temperatura en las reacciones químicas que han realizado los alumnos hasta el momento.
Recuerda a los alumnos que la reacción de descomposición del peróxido de hidrógeno y la reacción con sulfato de cobre II y aluminio causaron un aumento de la temperatura de la solución. Diles a los alumnos que les mostrarás tres reacciones químicas en las que la temperatura aumenta drásticamente.
Proyecta el video Reacción termita.
Después de añadir uno o más catalizadores, el óxido de hierro (óxido) y el aluminio reaccionan para producir hierro elemental y óxido de aluminio. En esta reacción se produce tanto calor que el hierro se convierte en líquido. El calor es tan intenso que el hierro fundido se puede utilizar para soldar las vías de ferrocarril.
Proyecta el video Reacción del triyoduro de nitrógeno.
Se trata de una reacción de descomposición en la que el triyoduro de nitrógeno se descompone en gas de nitrógeno y vapor de yodo violeta. Los cristales de triyoduro de nitrógeno son tan inestables que incluso un toque ligero hará que se descompongan rápidamente y generen una gran cantidad de calor.
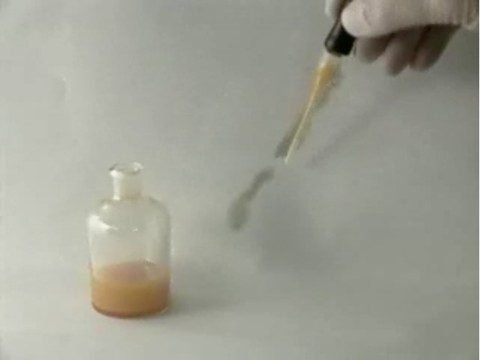
Proyecta el video Reacción de fósforo blanco.
El fósforo blanco se disuelve en un disolvente y se esparce sobre un trozo de papel. Cuando el disolvente se evapora, el fósforo reacciona con el oxígeno del aire en una reacción de combustión.
Pide a los alumnos que hagan una predicción:
- ¿Creen que las sustancias pueden reaccionar y provocar que la temperatura de la mezcla disminuya?
Diles a los alumnos que esta lección explorará los cambios de temperatura en las reacciones químicas.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 6.7 Hoja de actividades PDF | DOCX | Google Doc
- Lección 6.7 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Observa la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explora
Paso 2
Pide a los alumnos que midan el cambio en la temperatura de la reacción entre el bicarbonato y el vinagre.
Pregunta para investigar
¿Aumenta, disminuye o permanece igual la temperatura en la reacción entre el bicarbonato y el vinagre?
Materiales
- Vinagre en un vaso
- Bicarbonato en un vaso
- Termómetro
Nota sobre los materiales: La cantidad de las soluciones debe ser suficiente como para cubrir el bulbo del termómetro. Si no lo es, utiliza un vaso más pequeño o recorta el extremo de un termómetro con soporte de plástico para que el soporte quede al mismo nivel que la parte inferior del bulbo.
Preparación del maestro
- Coloca aproximadamente 10 ml de vinagre en un vaso pequeño de plástico para cada grupo.
- Coloca aproximadamente ½ cucharadita de bicarbonato en un vaso pequeño para cada grupo.

Procedimiento
- Coloca un termómetro en el vinagre. Lee el termómetro y registra la temperatura en la hoja de actividades.
- Mientras el termómetro esté en el vaso, añade todo el bicarbonato de tu vaso.
- Mira el termómetro para observar cualquier cambio en la temperatura. Registra la temperatura después de que haya dejado de cambiar.
Resultados esperados
Si comienzas con el vinagre a temperatura ambiente, la temperatura disminuirá unos 7 °C. La magnitud en que disminuya la temperatura variará. También se produce gas de dióxido de carbono.
Paso 3
Analiza las observaciones de los alumnos.
Pregunta a los alumnos:
- ¿Aumentó, disminuyó o permaneció igual la temperatura cuando combinaste bicarbonato y vinagre?
La temperatura disminuyó. - ¿Cuál es la temperatura más baja alcanzada durante la reacción de tu grupo?
Probablemente habrá alguna variación.
Diles a los alumnos que cuando la temperatura de una reacción química disminuye, la reacción se denomina endotérmica. La primera parte de la palabra, endo, significa dentro o dentro de y térmica tiene que ver con el calor o la energía. Por lo tanto, una reacción endotérmica significa que se utiliza más energía para hacer que se produzca la reacción que la que la reacción libera. Esto hace que la mezcla de la reacción se mantenga a una temperatura más baja.
Paso 4
Pide a los alumnos que midan el cambio de temperatura de la reacción entre la solución de bicarbonato y el cloruro de calcio.
Pregunta para investigar
¿Aumenta, disminuye o permanece igual la temperatura en la reacción entre la solución de bicarbonato y el cloruro de calcio?
Materiales
- Solución de bicarbonato en un vaso
- Cloruro de calcio en un vaso
- Termómetro
Preparación del maestro
- Haz una solución de bicarbonato disolviendo unas 2 cucharadas de bicarbonato en 1 vaso de agua. Remueve hasta que no se disuelva más el bicarbonato.
- Coloca aproximadamente 10 ml de la solución de bicarbonato en un vaso pequeño de plástico para cada grupo.
- Coloca aproximadamente ½ cucharadita de cloruro de calcio en un vaso pequeño para cada grupo.
Procedimiento
- Coloca un termómetro en la solución de bicarbonato. Lee el termómetro y registra la temperatura en la hoja de actividades.
- Con el termómetro aún en el vaso, añade todo el cloruro de calcio del vaso.
- Mira el termómetro para observar cualquier cambio en la temperatura. Registra la temperatura después de que haya dejado de cambiar.
Resultados esperados
La temperatura de la solución debe aumentar unos 15 °C a 20 °C. El aumento de temperatura variará. Se produce gas de dióxido de carbono y se forma un precipitado blanco turbio, carbonato de calcio.
Nota: Parte del aumento de la temperatura en esta reacción puede deberse a la reacción química entre el bicarbonato y el cloruro de calcio, pero algo también se debe a la forma exotérmica en que el cloruro de calcio se disuelve en agua. El Capítulo 5, Lección 9 aborda los cambios de temperatura a medida que se rompen los enlaces entre un soluto y el agua durante el cambio físico de la disolución.
Lee más sobre las reacciones químicas exotérmicas y endotérmicas en Información contextual para el maestro.
- Lección 6.7 Información contextual para el maestro PDF
Paso 5
Analiza las observaciones de los alumnos.
Pregunta a los alumnos:
- ¿Aumentó, disminuyó o permaneció igual la temperatura cuando combinaste la solución de bicarbonato y el cloruro de calcio?
La temperatura aumentó. - ¿Cuál es la temperatura más alta alcanzada durante la reacción de tu grupo?
Probablemente habrá alguna variación.
Diles a los alumnos que cuando la temperatura de una reacción química aumenta, la reacción se denomina exotérmica. La primera parte de la palabra, exo, significa fuera o fuera de, y térmica tiene que ver con el calor o la energía. Por lo tanto, una reacción exotérmica significa que la reacción libera más energía que la que ingresa en ella. Esto hace que la mezcla de la reacción se mantenga a una temperatura más alta.
4 Explica
Paso 6
Explica cómo las diferencias en la energía necesaria para romper los enlaces y hacer enlaces causan cambios de temperatura durante las reacciones químicas.
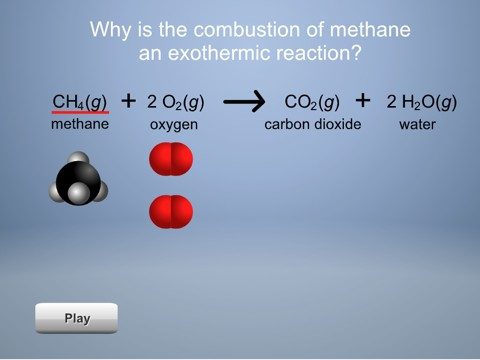
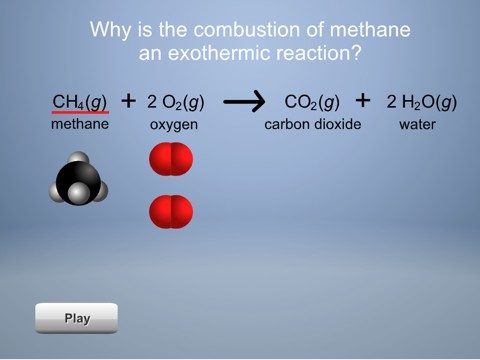
Diles a los alumnos que un ejemplo de una reacción muy exotérmica es la combustión o quema de combustible como el gas en una cocina. Incluso si los alumnos han visto la animación de la combustión del metano del Capítulo 6, Lección 1, recuérdales que el metano (CH4) reacciona con el oxígeno (O2) del aire para producir gas de dióxido de carbono (CO2) y vapor de agua (H2O) y mucha energía.
Proyecta la animación Energía de la combustión del metano.
Haz clic en el metano y el oxígeno para mostrar que se necesita energía para romper los enlaces de los reactivos. Esto se muestra mediante “flechas de energía” que van hacia las moléculas de los reactivos. A continuación, haz clic en el dióxido de carbono y el agua para mostrar que se libera energía cuando los átomos se unen para fabricar los productos. Esto se muestra mediante las flechas de energía que salen de las moléculas de los productos.
Muestra a los alumnos que se liberó más energía cuando se formaron los enlaces de los productos que la que se utilizó para romper los enlaces de los reactivos. Esto se muestra mediante flechas de energía más grandes que salen de los productos y flechas de energía más pequeñas que ingresan en los reactivos. Dado que se liberó más energía que la utilizada, esta reacción se torna más caliente y es exotérmica.
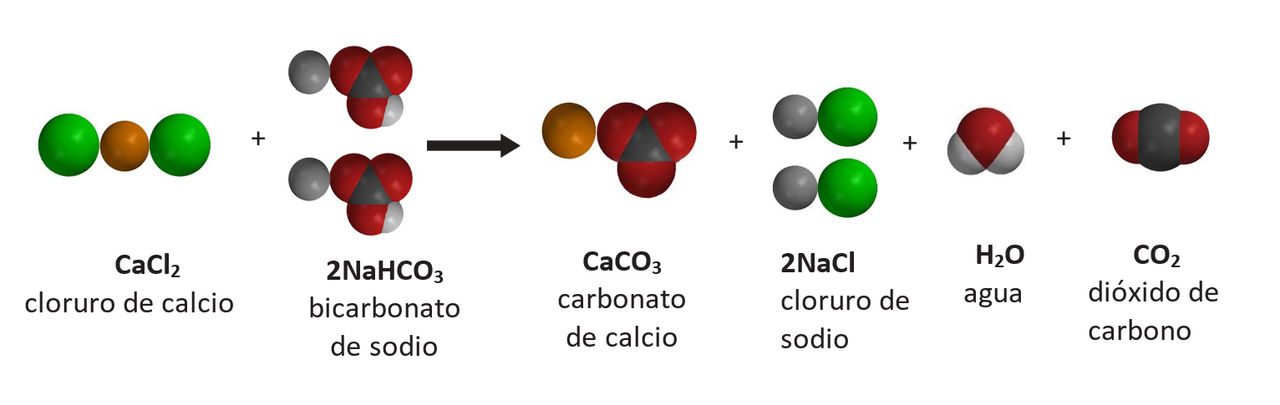
Proyecta la imagen Reacción entre el bicarbonato y el cloruro de calcio.
Pregunta a los alumnos:
- ¿Se trata de una reacción endotérmica o exotérmica?
Es exotérmica. - ¿Qué sabes sobre la cantidad de energía necesaria para romper los enlaces de los reactivos en comparación con la cantidad de energía liberada cuando se forman los enlaces en los productos?
Se liberó más energía cuando se formaron los enlaces en los productos que la necesaria para romper los enlaces en los reactivos. - Si usáramos flechas de energía, ¿dónde iría la flecha más grande y la más pequeña?
Una flecha más pequeña que ingresa estaría en el lado del reactivo y una flecha más grande que sale, en el lado del producto.
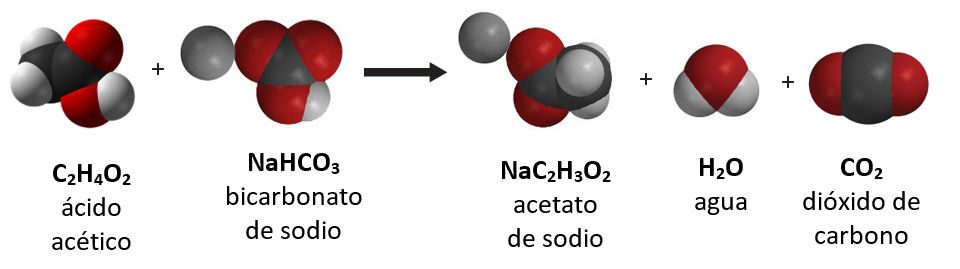
Proyecta la imagen Reacción entre el bicarbonato y el vinagre.
Pregunta a los alumnos:
- ¿Se trata de una reacción endotérmica o exotérmica?
Endotérmica. - ¿Qué sabes sobre la cantidad de energía necesaria para romper los enlaces de los reactivos en comparación con la cantidad de energía liberada cuando se forman los productos?
Se necesitó más energía para romper los enlaces de los reactivos que la que se liberó cuando se formaron los enlaces de los productos. - Si usáramos flechas de energía, ¿dónde iría la flecha más grande y la más pequeña?
Una flecha más grande que ingresa estaría en el lado del reactivo y una flecha más pequeña que sale, en el lado del producto.
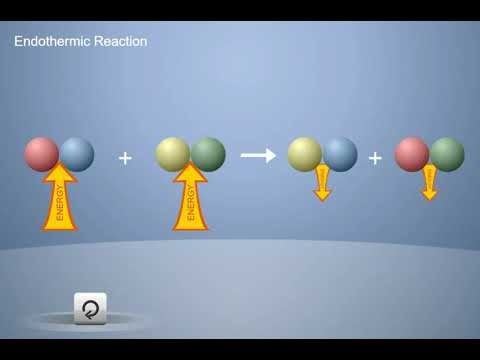
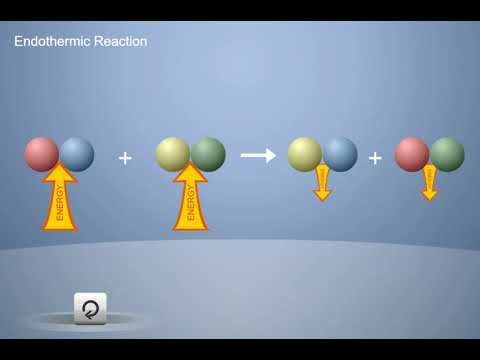
Proyecta la animación Reacción endotérmica.
Recuerda a los alumnos que una reacción química implica la ruptura de enlaces en los reactivos y la fabricación de enlaces en los productos. Recuérdales también que se necesita energía para romper los enlaces y que se libera energía cuando se forman los enlaces.
En una reacción endotérmica, se necesita más energía para romper los enlaces de los reactivos que la que se libera cuando se forman los enlaces de los productos. En una reacción endotérmica, la temperatura desciende.
Proyecta la animación Reacción exotérmica.
Explica que en una reacción exotérmica, se necesita menos energía para romper los enlaces de los reactivos que la que se libera cuando se forman los enlaces de los productos. En una reacción exotérmica, la temperatura sube.
5 Amplía
Paso 7
Pide a los alumnos que expliquen cómo los cambios de energía durante las reacciones químicas hacen que sean endotérmicas o exotérmicas.
Diles a los alumnos que usarán sus conocimientos sobre las reacciones endotérmicas y exotérmicas para describir los cambios de energía que se producen cuando se activan los calentadores de manos y los globos de inflado automático. Estos dos productos diferentes utilizan reacciones químicas para funcionar.
Materiales para cada grupo
- Calentador de manos de autocalentamiento desechable
- Globo de inflado automático
Calentador de manos
Diles a los alumnos que el embalaje exterior del calentador de manos evita que se produzca la reacción química hasta el momento en que el consumidor quiere que empiece a producir calor. El oxígeno en el aire es uno de los reactivos de la reacción química. De esta forma, una vez abierto el envase, el polvo de hierro del calentador de manos reacciona con el oxígeno del aire.
Globo de inflado automático
Diles a los alumnos que la reacción química que hace que el globo de inflado automático se infle es muy similar a una reacción química que los alumnos ya han explorado. Pide a los alumnos que sientan suavemente el globo de inflado automático para adivinar cuáles son los reactivos. Deben notar un comprimido y un envase sellado de líquido dentro del globo. Explica que el comprimido es bicarbonato y que el líquido del paquete es ácido cítrico, que reacciona con el bicarbonato de una manera similar al vinagre. El paquete sellado evita que el ácido cítrico reaccione con el bicarbonato.
Procedimiento
- Abre el paquete en el que se encuentra el calentador de manos para iniciar la reacción química.
- Agita el calentador de manos y advierte cualquier cambio de temperatura.
- Activa el globo de inflado automático presionando hacia abajo o apoyando el pie sobre el empaque de ácido cítrico para romperlo.
- Agita el globo y siente la zona del globo en la que se encuentra el líquido.
- Asegúrate de que todos los miembros de tu grupo tengan la oportunidad de sentir tanto el globo de inflado automático como el calentador de manos.
Resultados esperados
El calentador de manos se calentará y el líquido del globo de inflado automático se enfriará. El globo se inflará a medida que se produzca gas de dióxido de carbono.
Pregunta a los alumnos:
- ¿Cuál es un ejemplo de una reacción endotérmica? ¿Y de una reacción exotérmica?
El globo de inflado automático es un ejemplo de reacción endotérmica y el calentador de manos es un ejemplo de reacción exotérmica. - ¿Qué puedes decir sobre la cantidad de energía necesaria para romper los enlaces en los reactivos en comparación con la cantidad de energía que se libera cuando se forman enlaces en los productos del globo de inflado automático?
Para el globo de inflado automático, se necesita más energía para romper los enlaces en los reactivos que la que se libera cuando se forman los productos. Por lo tanto, la reacción es endotérmica. - ¿Qué puedes decir sobre la cantidad de energía necesaria para romper los enlaces en los reactivos en comparación con la cantidad de energía que se libera cuando se forman enlaces en los productos en el calentador de manos?
En el calentador de manos, se libera más energía cuando se forman los nuevos enlaces de los productos que cuando se utilizan para romper los enlaces de los reactivos. Por lo tanto, la reacción es exotérmica. - ¿Cuál crees que es el gas dentro del globo de inflado automático?
El gas de dióxido de carbono se produce cuando reaccionan el ácido cítrico y el bicarbonato.
Si no tienes acceso a un globo de inflado automático, puedes optar por que los alumnos hagan uno propio.
Materiales para cada grupo
- Comprimido de Alka-Seltzer
- Agua
- Cilindro graduado
- Bolsa plástica pequeña, con cierre hermético
Procedimiento
- Coloca 10 ml de agua en una bolsa de plástico con cierre.
- Inclina la bolsa abierta en ángulo para que el agua fluya hacia una esquina. Sujeta la bolsa mientras un compañero coloca el comprimido de Alka-Seltzer en la esquina opuesta. Deja salir la mayor cantidad de aire posible y sella la bolsa de manera segura.
- Agita la bolsa para ayudar a que el agua y el comprimido reaccionen. Coloca la bolsa en un cuenco u otro recipiente por si se rompe.
- Siente el líquido cerca del comprimido para ver si hay algún cambio de temperatura.
Resultados esperados
El líquido se enfriará y la bolsa se inflará, y podría romperse.
Paso 8
Pide a los alumnos que identifiquen pistas de un cambio químico en las siguientes reacciones.
Recuerda a los alumnos que en este capítulo han visto diferentes pistas de cambios químicos. Pide a los alumnos que identifiquen todas las pistas que observan en esta combinación de reacciones químicas.
Pregunta para investigar
¿Qué pistas puedes observar de que se está produciendo una reacción química?
Materiales para cada grupo
- Solución de sulfato de magnesio en un vaso
- Solución de carbonato de sodio en un vaso
- Solución de ácido cítrico en un vaso
- Indicador universal
- Termómetro
- Gotero
Preparación del maestro
- Etiqueta 3 vasos pequeños con los nombres “sulfato de magnesio”, “carbonato de sodio” y “ácido cítrico” para cada grupo.
- Prepara cada solución añadiendo:
- 1 cucharada de sulfato de magnesio a 250 ml de agua.
- 1 cucharadita de carbonato de sodio a 125 ml de agua.
- 1 cucharadita de ácido cítrico a 125 ml de agua.
- Vierte 30 ml de sulfato de magnesio, 10 ml de carbonato de sodio y 10 ml de solución de ácido cítrico en los vasos etiquetados correspondientes para cada grupo.
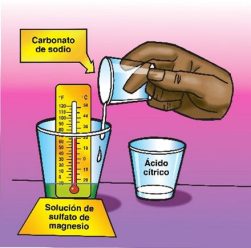
Procedimiento
- Añade 5 gotas de indicador universal a la solución de sulfato de magnesio.
- Coloca un termómetro en el vaso y registra la temperatura de la solución.
- Añade 10 ml de solución de carbonato de sodio.
- Añade 10 ml de ácido cítrico.
Resultados esperados
El sulfato de magnesio, el indicador universal y el carbonato de sodio se volverán violetas y formarán un precipitado. Con la adición de ácido cítrico, la mezcla se volverá amarilla o rosada, y formará burbujas a medida que el precipitado desaparezca. No se aprecia ningún cambio de temperatura.
Pregunta a los alumnos:
- ¿Qué pistas pueden observar que les permitan saber que se está produciendo una reacción química?
Hay un cambio de color, formación de un precipitado, otro cambio de color y formación de burbujas. - ¿Cómo puede ser que en esta reacción química no hayan notado un cambio de temperatura?
Quizá la cantidad de energía necesaria para romper los enlaces era aproximadamente la misma que la cantidad de energía liberada para formarlos. O el cambio de temperatura era tan pequeño que no era perceptible para los termómetros de los alumnos.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Simulaciones
Descargas
Para los estudiantes
- Lección 6.7 Hoja de actividades PDF | DOCX | Google Doc
Para los Maestros
- Lección 6.7 Plan de lección PDF | DOCX | Google Doc
- Lección 6.7 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
- Lección 6.7 Información contextual para el maestro PDF
Recursos para el Capítulo 6
- Capítulo 6 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 6 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda