¿Qué es la densidad?
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- La densidad es una propiedad característica de una sustancia.
- La densidad de una sustancia es la relación entre la masa de la sustancia y el espacio que ocupa (volumen).
- La masa de los átomos, su tamaño y la forma en que están dispuestos determinan la densidad de una sustancia.
- La densidad es igual a la masa de la sustancia dividida entre su volumen; D = m/v.
- Los objetos con el mismo volumen, pero con diferentes masas tienen diferentes densidades.
Resumen
Los alumnos observarán un cubo de cobre y un cubo de aluminio del mismo volumen colocado en una balanza. Verán que el cobre tiene una mayor masa. Los alumnos intentarán elaborar una explicación, a nivel molecular, de por qué ocurre esto. Luego, los alumnos recibirán cubos de materiales diferentes que tienen el mismo volumen. Deben determinar la densidad de cada cubo e identificar la sustancia a partir de la cual está hecho el cubo.
Objetivo
Los alumnos podrán calcular la densidad de diferentes cubos y usar estos valores para identificar la sustancia de la que está compuesto cada cubo. Los alumnos podrán explicar que el tamaño, la masa y la disposición de los átomos o las moléculas de una sustancia determinan su densidad.

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas.
Materiales para cada grupo
- Cubos marcados de la A a la H que compartirán con otros grupos.
- Una balanza que tome las medidas en gramos
- Calculadora
Materiales para la demostración
- Cubo de cobre y cubo de aluminio del mismo volumen
- Balanza
Notas sobre los materiales
Cubos
Para esta lección, necesitarás un conjunto de cubos de diferentes materiales que tengan el mismo volumen. Estos conjuntos de cubos están disponibles de una variedad de proveedores. Deberás disponer de un conjunto de cubos que contengan cobre, latón, acero, aluminio, PVC, nailon, roble y pino o álamo. En la actividad, cada grupo deberá medir la masa de cada uno de los ocho cubos. Los grupos deberán medir y registrar sus datos para un cubo y pasarlo a otro grupo hasta que cada grupo haya utilizado cada uno de los cubos.
Balanzas
Para la demostración, usa una balanza simple de dos platillos, de plástico, de los que parecen un balancín. Pide a los alumnos que usen cualquier balanza que realice la medición en gramos.
Regla métrica
Los alumnos utilizarán una regla métrica en la parte “Activar” de la actividad para medir la longitud, el ancho y la altura de un cubo junto contigo.
Acerca de esta lección
Esta es la primera lección en la que los alumnos ven modelos de moléculas que son más complejas que una molécula de agua. Algunas de estas moléculas pueden parecer un poco intimidantes. Informa a los alumnos que no deberán memorizar ni dibujar estas moléculas. A los fines de este capítulo, los alumnos solo necesitan pensar en el tamaño y la masa de los átomos que conforman la molécula y cómo están dispuestos en la sustancia.
Descarga todos los recursos de la Lección 3.1
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 3.1: ¿Qué es la densidad?"
Instrucciones
1 Involúcrate
Paso 1
Haz una demostración para mostrar qué cubos del mismo volumen, pero hechos de diferentes metales tienen diferentes masas.
Pregunta para investigar
Los cubos que tienen exactamente el mismo tamaño y forma, ¿tienen la misma masa?
Materiales para la demostración
- Cubo de cobre y cubo de aluminio del mismo volumen
- Balanza

Procedimiento
Coloca el cubo de cobre y aluminio en los lados opuestos de una balanza simple.
Resultados esperados
El cubo de cobre tendrá una masa mayor que el cubo de aluminio.
Paso 2
Guía el debate sobre por qué el cubo de cobre tiene una mayor masa que el cubo de aluminio.
Diles a los alumnos que ambos cubos tienen exactamente el mismo tamaño y que ambos son sólidos, sin partes huecas. Explica que el cubo de aluminio está hecho solo de átomos de aluminio y el cubo de cobre está hecho solo de átomos de cobre.
Pregunta a los alumnos:
- ¿Cómo pueden dos objetos, que tienen exactamente el mismo tamaño y la misma forma, tener una masa diferente?
Ayuda a los alumnos a entender que la diferencia de masa debe tener que ver con los átomos de cada cubo. Existen tres explicaciones posibles sobre los átomos de cobre y aluminio en los cubos que podrían explicar la diferencia de masa.
- Los átomos de cobre pueden tener más masa que los átomos de aluminio.
- Los átomos de cobre podrían ser más pequeños, de modo que una mayor cantidad pueda caber en el mismo volumen.
- Los átomos de cobre y los del aluminio pueden estar dispuestos de manera diferente, de modo que una mayor cantidad de átomos de cobre pueda entrar en un cubo del mismo tamaño.
Explica que cualquiera de estas explicaciones por sí misma, o dos o tres juntas, podría ser el motivo por el cual el cubo de cobre tiene más masa.
Entrega a cada alumno una hoja de actividades.
- Lección 3.1 Hoja de actividades PDF | DOCX | Google Doc
- Lección 3.1 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Mira la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
Paso 3
Proyecta una ilustración y utiliza las imágenes de los átomos de cobre y aluminio para introducir el concepto de densidad.
Pide a los alumnos que pasen a la ilustración de los cubos de cobre y aluminio y sus átomos en su hoja de actividades.
Muestra a los alumnos la imagen Átomos de cobre y de aluminio.
Explique a los estudiantes que los átomos de cobre y aluminio están organizados de la misma manera en sus cubos. Los átomos de cobre son un poco más grandes que los átomos de aluminio. Esto significa que hay menos átomos de cobre en el cubo de cobre que átomos de aluminio en el cubo de aluminio. Pero los átomos de cobre tienen mucha más masa que los átomos de aluminio. Entonces, aunque no haya tantos átomos de cobre, su masa extra lo compensa y hace que el cubo de cobre sea más pesado que el cubo de aluminio del mismo tamaño y forma (volumen).
Nota: Existen diferentes formas de medir el tamaño de los átomos y, en casos similares, los resultados no siempre coinciden. Esto es cierto con el cobre y el aluminio. Algunas fuentes informan que el cobre es mayor según algunas medidas y otras informan que el aluminio es mayor. Para los propósitos de esta lección, trataremos al cobre como el átomo más grande.
Explica a los alumnos que esta idea de cuán pesado es algo en comparación con la cantidad de espacio que ocupa se denomina densidad. La densidad de un objeto es la masa del objeto comparada con su volumen. La ecuación para la densidad es:
Densidad = masa/volumen o D = m/v. Cada sustancia tiene su propia densidad característica debido al tamaño, la masa y la disposición de sus átomos o moléculas.
Paso 4
Muestra animaciones y haz una demostración de cómo medir el volumen y la masa de un cubo.
Explica a los alumnos que el volumen es una medida de la cantidad de espacio que ocupa un objeto. Siempre está en tres dimensiones. Para encontrar el volumen de un objeto como un cubo o una caja, mide la longitud, el ancho y la altura, y luego multiplícalos (V = largo × ancho × altura). Si se mide en centímetros, la respuesta estará en centímetros cúbicos (cm3).
Nota: A menudo, los alumnos confunden volumen y área. Comprueba que hayan comprendido para asegurarte de que conocen la diferencia. Asegúrate de que entiendan que el área se mide en dos dimensiones (largo × ancho) y que el resultado estará en cm2. El área es una medida de la cantidad de superficie. Pero el volumen se mide en tres dimensiones (largo × ancho × alto) con una respuesta en cm3. El volumen es una medida de todo el objeto, incluida la superficie y todo el espacio que ocupa el objeto.
Muestra la animación Cubo.
Mientras se reproduce la animación, puedes hacer la demostración sobre el proceso de medición usando un cubo y una regla. Pide a los alumnos que tomen la medida contigo para confirmar el volumen de los cubos.
Volumen
Los cubos tienen 2.5 centímetros en cada lado. Muestra a los alumnos que para calcular el volumen, debes multiplicar la longitud (2.5 cm) por el ancho (2.5 cm) por la altura (2.5 cm) para obtener 15.625 cm3. Redondear este número a 15.6 cm3 tiene una precisión suficiente y facilitará los cálculos de densidad. Registra el volumen del cubo en centímetros cúbicos (cm3).
Masa
Haz una demostración sobre cómo usar la balanza que los alumnos utilizarán para medir la masa del cubo. Registra la masa del cubo en gramos (g).
Densidad
Muestra a los alumnos cómo calcular la densidad dividiendo la masa entre el volumen. Señala que la respuesta será en gramos por centímetro cúbico (g/cm3).
2 Evalúa
- Lección 3.1 Hoja de actividades PDF | DOCX | Google Doc
- Lección 3.1 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Mira la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explora
Paso 5
Pide a los alumnos que calculen la densidad de ocho cubos diferentes y que usen la propiedad característica de la densidad para identificarlos correctamente.
Los grupos de alumnos no necesitarán medir el volumen de los cubos. El volumen de cada cubo es el mismo, 15.6 cm3 , y aparece en tu tabla de la hoja de actividades. Deberán medir la masa de cada uno de los ocho cubos diferentes y calcular sus densidades. Los alumnos usarán sus valores de densidad a fin de identificar cada cubo.
Nota: Es posible que las densidades calculadas por los alumnos no sean exactamente las mismas que las densidades dadas en esta tabla. Sin embargo, sus cálculos estarán lo suficientemente cerca como para que puedan identificar la mayoría de los cubos.
Pregunta para investigar
¿Puedes usar la densidad para identificar ocho cubos compuestos de materiales diferentes?
Materiales para la clase
- Conjunto de ocho cubos de igual volumen
- Calculadora
Preparación del maestro
Usa un trozo de cinta de papel y un marcador permanente para marcar los ocho cubos con las letras A-H.
Materiales para cada grupo
- Cubos marcados de la A a la H que compartirán con otros grupos.
- Una balanza que tome las medidas en gramos
- Calculadora
Procedimiento
- El volumen de cada cubo se indica en la tabla. Es de 15.6 cm3.
- Busca la masa en gramos de cada cubo usando una balanza. Registra esta masa en la tabla.
- Intercambia los cubos con otros grupos hasta que hayan medido la masa de los ocho cubos.
- Calcula la densidad
usando la fórmula D = m/v y regístrala en el gráfico.
| Muestra | Volumen (cm3) | Masa (g) | Densidad (g/cm3) | Material |
A | 15.6 |
|
|
|
B | 15.6 |
|
|
|
C | 15.6 |
|
|
|
D | 15.6 |
|
|
|
E | 15.6 |
|
|
|
F | 15.6 |
|
|
|
G | 15.6 |
|
|
|
H | 15.6 |
|
|
|
- Compara el valor que has encontrado para la densidad con el valor dado en el cuadro a continuación para identificar a partir de qué material está hecho cada cubo. Anota en el cuadro el nombre del material para los cubos A-H.
Material | Densidad aproximada (g/cm3) |
Aluminio | 2.9 |
Latón | 8.8 |
Cobre | 9.3 |
Acero | 8.2 |
PVC | 1.3 |
Nailon | 1.2 |
Roble | 0.7–0.9 |
Pino o álamo | 0.4–0.6 |
Resultados esperados: Los valores de la densidad de cada cubo calculados por los alumnos no serán exactos, pero serán lo suficientemente parecidos como para que puedan identificar cada uno de los cubos. Es posible que noten que las densidades aproximadas dadas para cada cubo en esta lección son ligeramente diferentes a las del juego de cubos. La mayor parte de esta diferencia probablemente se deba al valor del volumen de cada cubo. Ya que es probable que estos sean cubos de 1 pulgada, cada lado debería tener 2.54 cm. Redondeamos a 2.5 cm porque los alumnos pueden hacer esta medición más fácilmente.
4 Explica
Paso 6
Analiza cómo la masa, el tamaño y la disposición de los átomos y las moléculas afectan las densidades del metal, el plástico y la madera.
Explica a los alumnos que cada sustancia tiene su propia densidad debido a los átomos y las moléculas a partir de los cuales está hecha. Los cubos de metal, plástico y madera que los alumnos midieron tienen su propia densidad específica. En general, la densidad del metal, el plástico y la madera puede explicarse observando el tamaño y la masa de los átomos y cómo estos se disponen.
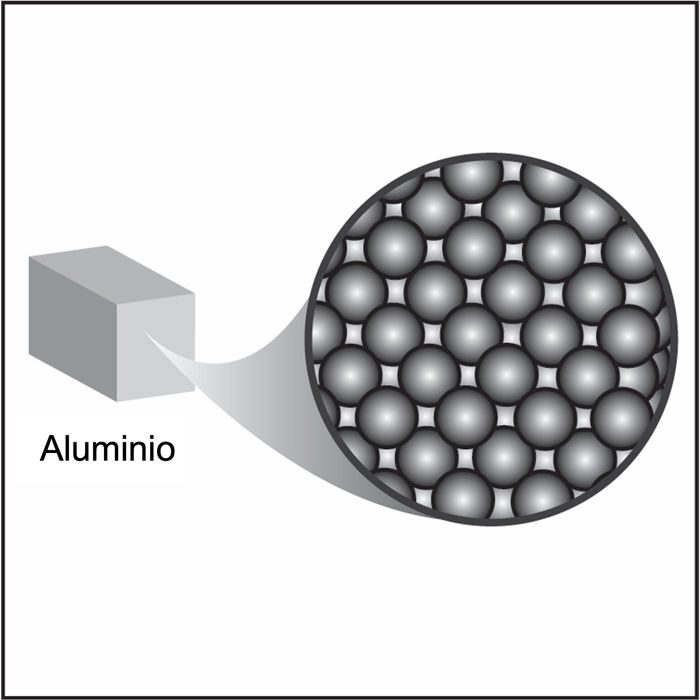
Proyecta la imagen Metal.
Los metales más comunes, como el aluminio, el cobre y el hierro, son más densos que el plástico o la madera. Los átomos que componen los metales generalmente son más pesados que los átomos del plástico y la madera, y están más apretados entre sí. La diferencia de densidad entre los diferentes metales generalmente depende del tamaño y la masa de los átomos, pero la disposición de los átomos en la mayoría de los metales se mantiene, en general.
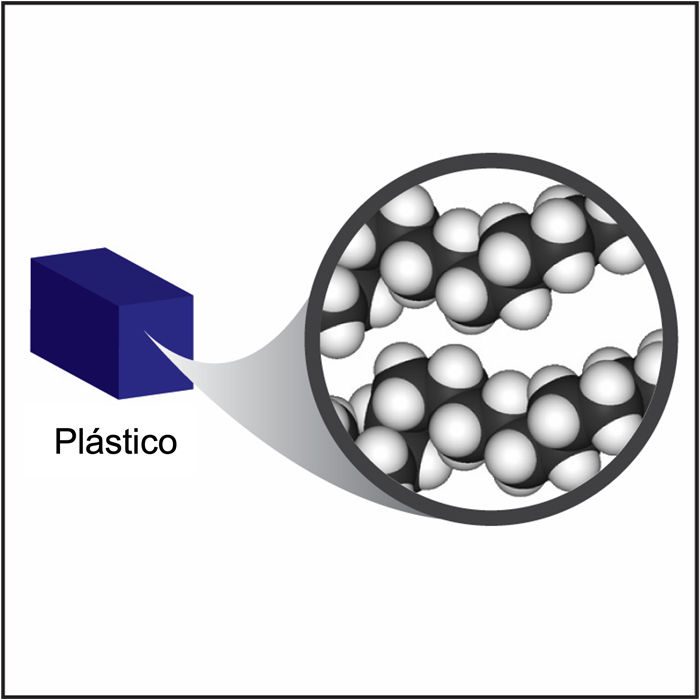
Proyecta la imagen Plástico.
La mayoría de los plásticos son menos densos que el metal, pero pueden tener una densidad similar a la madera. Los plásticos están hechos de moléculas individuales unidas en cadenas largas llamadas polímeros. Estas cadenas de polímeros se disponen y aprietan para hacer el plástico. Un plástico común, el polietileno, está compuesto por muchas moléculas individuales llamadas etileno, que se unen para formar las largas cadenas de polímeros. Al igual que la mayoría de los plásticos, los polímeros en el polietileno están hechos de átomos de carbono y de hidrógeno.
El carbono y los átomos de hidrógeno son muy livianos, lo que ayuda a que los plásticos tengan una densidad relativamente baja. Los plásticos pueden tener diferentes densidades porque diferentes átomos pueden unirse a las cadenas de carbono-hidrógeno. La densidad de los diferentes plásticos también depende de la proximidad de estas cadenas de polímeros entre sí.
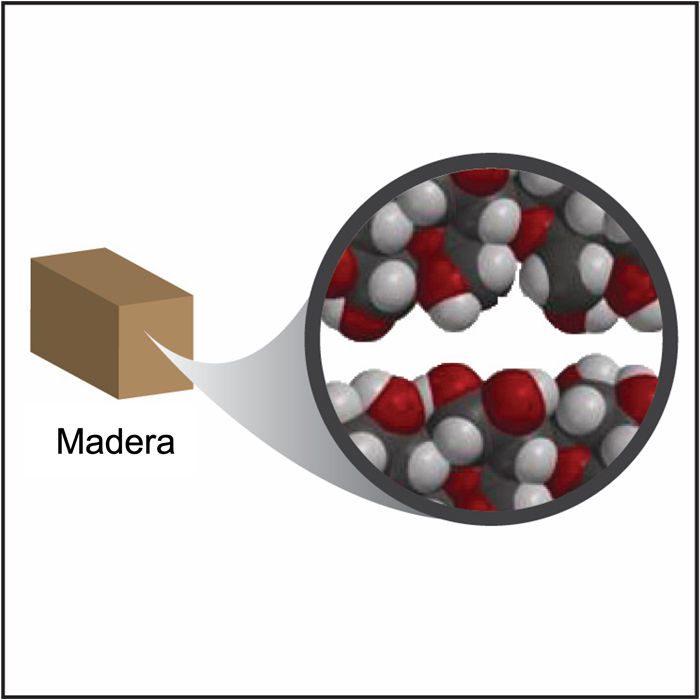
Proyecta la imagen Madera.
La madera está compuesta principalmente por átomos de carbono, hidrógeno y oxígeno unidos a una molécula denominada glucosa. Estas moléculas de glucosa se unen para formar cadenas largas llamadas celulosa. Muchas moléculas de celulosa apiladas dan a la madera su estructura y densidad.
En general, la densidad de la madera y el plástico son similares porque están hechos de átomos similares dispuestos en cadenas largas. La diferencia de densidad se basa principalmente en la disposición y la proximidad de las cadenas de polímeros. Además, como la madera proviene de un ser viviente, su densidad se ve afectada por la estructura de las células vegetales y otras sustancias que la conforman.
Pregunta a los alumnos:
El tamaño, la masa y la disposición de los átomos afectan la densidad de una sustancia.
- ¿Cómo podrían cooperar estos factores para hacer que una sustancia tenga una densidad alta?
Una sustancia con átomos más pequeños y masivos que están cerca entre sí tendrá una densidad más alta.. - ¿Cómo podrían cooperar estos factores para hacer que una sustancia tenga una baja densidad?
Una sustancia con átomos más grandes y más livianos que están más separados va a tener una densidad más baja.
5 Amplía
Paso 7
Pide a los alumnos que expliquen a nivel molecular por qué dos bloques de materiales diferentes que tienen la misma masa pueden tener densidades diferentes.
Recuerda a los alumnos que los cubos que observaron tenían el mismo volumen pero diferente masa. Señala que su hoja de actividades contiene dibujos de dos bloques (muestra A y muestra B) hechos de sustancias diferentes que tienen la misma masa, pero volúmenes diferentes.
Pregunta a los alumnos:
- ¿Cuál es la densidad de la muestra A?
Volumen = 5 × 5 × 4 = 100 cm3
Masa = 200 g
Densidad = 200 g/100 cm3 = 2 g/cm3
- ¿Cuál es la densidad de la muestra B?
Volumen = 5 × 5 × 2 = 50 cm3
Masa = 200 g
Densidad = 200 g/50 cm3 = 4 g/cm3
Da dos explicaciones posibles de por qué una muestra es más densa que la otra.

Pista: el tamaño, la masa y la disposición de las moléculas afectan la densidad de una sustancia. Existen varias respuestas posibles sobre por qué la muestra B es más densa que la muestra A.
- Los átomos de la muestra B podrían tener más masa que los átomos de la muestra A.
- Los átomos de la muestra B podrían ser más pequeños que los átomos de la muestra A, de modo que más puedan entrar en el mismo volumen.
- Los átomos de la muestra B podrían disponerse de manera diferente, de modo que más átomos de la muestra B que de la muestra A puedan caber en un cubo del mismo tamaño.
Cualquiera de estas explicaciones por sí mismas, o en cualquier combinación, podría ser el motivo por el cual la muestra B es más densa que la muestra A.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Descargas
Para los estudiantes
- Lección 3.1 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 3.1 Plan de lección PDF | DOCX | Google Doc
- Lección 3.1 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Recursos para el Capítulo 3
- Capítulo 3 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 3 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda