Cambio de estado—fusión
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- La fusión es un proceso que hace que una sustancia cambie de estado sólido a líquido.
- La fusión ocurre cuando las moléculas de un sólido se aceleran lo suficiente como para que el movimiento supere las atracciones, de modo que las moléculas puedan moverse unas en relación con otras cuando está en forma líquida.
Resumen
Los alumnos verán un pequeño trozo de hielo derretirse sobre una superficie de aluminio. En base a lo que han visto en los capítulos 1 y 2, los alumnos explicarán la transferencia de energía y el movimiento molecular que causan el cambio de estado de sólido a líquido. Los alumnos verán y analizarán una animación sobre la fusión del hielo y compararán los cambios de estado del agua con los cambios de estado de otras sustancias. También investigarán la sublimación del hielo seco a través de una demostración del maestro o de un video, si no hay hielo seco disponible.
Objetivo
Los alumnos podrán explicar, a nivel molecular, el proceso de transferencia de calor y el movimiento molecular que hace que un sólido se derrita para formar un líquido. Los alumnos también podrán explicar cómo la disposición de las moléculas de agua es diferente a la de la mayoría de las otras sustancias cuando cambia de estado sólido a líquido.

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas.
Materiales para cada grupo
- 2 trozos pequeños de hielo
- 2 vasos pequeños de plástico transparente
- Agua
Materiales para la demostración
- Hielo
- Hielo seco
- Toalla de papel marrón
- Agua fría
- Agua caliente
Descarga todos los recursos de la Lección 2.5
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 2.5: Cambio de estado—fusión."
Instrucciones
1 Involúcrate
Paso 1
Invita a los alumnos a que observen un pequeño trozo de hielo que se está derritiendo.
Muestra a los alumnos el video Fusión del hielo sobre diferentes superficies.
En este video, el hielo se coloca sobre dos superficies negras de apariencia similar: una de aluminio y otra de plástico. El hielo se derrite más rápido cuando está sobre el aluminio porque este es un mejor conductor térmico que el plástico.
Paso 2
Analiza las observaciones de los alumnos.

Pregunta a los alumnos:
- ¿De dónde crees que provino la energía para derretir el hielo?
La energía proviene del aire y de la superficie en la que se coloca el hielo, que están los dos a temperatura ambiente. Dado que la temperatura ambiente es más cálida que la temperatura del hielo, se transfiere energía de la superficie y del aire al hielo. - ¿Qué crees que sucedió con la velocidad de las moléculas en el hielo al calentarse?
Las moléculas de agua se movieron más rápido.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 2.5 Hoja de actividades PDF | DOCX | Google Doc
- Lección 2.5 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Consulta la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
Da a los alumnos tiempo para responder las primeras dos preguntas de la hoja de actividades.
3 Explora
Paso 3
Invita a los alumnos a que exploren cómo hacer que el hielo se derrita más rápido.
Presenta la pregunta para la investigación:
- ¿Cómo puedes hacer que el hielo se derrita más rápido?
Ayuda a los alumnos a planificar y llevar a cabo su experimento preguntando: - ¿Cómo podrías establecer un experimento para probar tu método?
Los alumnos pueden sugerir respirar sobre el hielo, sostenerlo en la mano o colocar el hielo en agua tibia o a temperatura ambiente. Cualquiera de estos métodos está bien, pero intenta que los alumnos piensen en incluir un control como parte del experimento. En cada caso, necesitarán dos trozos de hielo de tamaño similar: uno que calienten de alguna manera y otro que no.
Este es un método que los alumnos pueden intentar.
Pregunta para investigar
¿Colocar hielo en agua hará que el hielo se derrita más rápido?
Materiales
- 2 trozos pequeños de hielo
- 2 vasos pequeños de plástico transparente
- Agua
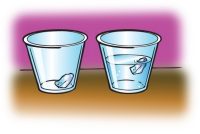
Procedure
- Add room-temperature water to a cup until it is about ½-full.
- Place a small piece of ice in the water and another small piece of ice in a cup without water.
Resultados esperados
El hielo en el agua se derretirá más rápido que el hielo sin agua expuesto al aire. Dado que tanto el agua como el aire se encuentran a temperatura ambiente, es posible que no sea evidente por qué el hielo se derrite más rápido cuando está en agua. Hay muchas más moléculas en el agua capaces de entrar en contacto con el hielo, de modo que la transferencia de calor al hielo es mucho más eficiente y más rápida en el agua que en el aire.
Da a los alumnos tiempo para que escriban su procedimiento y respondan la pregunta en la hoja de actividades.
4 Explica
Paso 4
Muestra una animación de un trozo de hielo que se está derritiendo.
Muestra la animación Fusión del hielo.
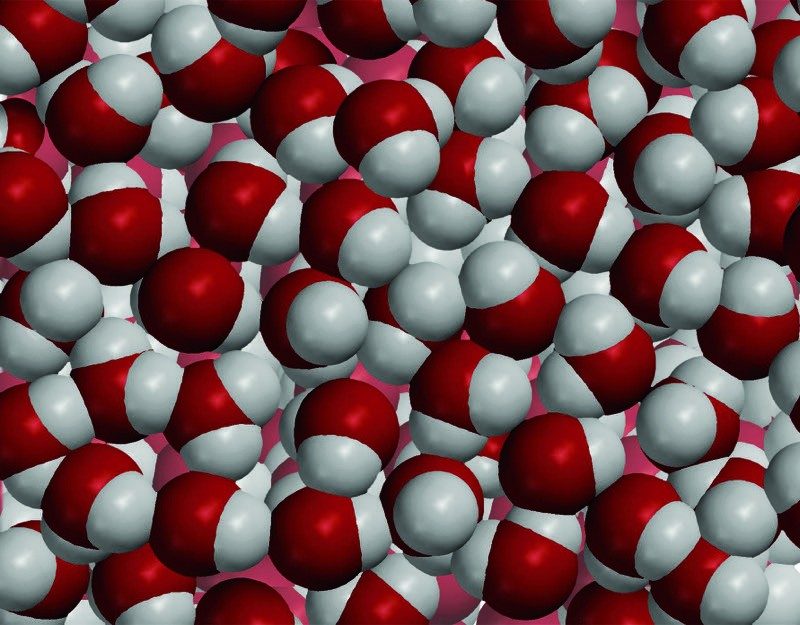
Señala que las moléculas de agua en el hielo vibran, pero que no se mueven en relación con las demás. A medida que aumenta la temperatura, comienzan a vibrar más. Con el tiempo, su movimiento supera sus atracciones y ya no pueden permanecer en su estructura cristalina ordenada. A medida que el hielo se derrite, la disposición ordenada colapsa y las moléculas de agua se mueven en relación con las demás y, de hecho, se acercan entre sí cuando están en forma de agua líquida.
Proyecta la imagen Hielo y agua.
Pregunta a los alumnos
- ¿Cómo cambió el movimiento y la disposición de las moléculas de agua a medida que se derritió el hielo?
A medida que se transfiere energía a las moléculas de agua en el hielo, aumenta el movimiento de las moléculas. El movimiento de las moléculas aumenta lo suficiente como para superar las atracciones que las moléculas de agua experimentan entre sí, haciendo que el hielo se derrita.
Paso 5
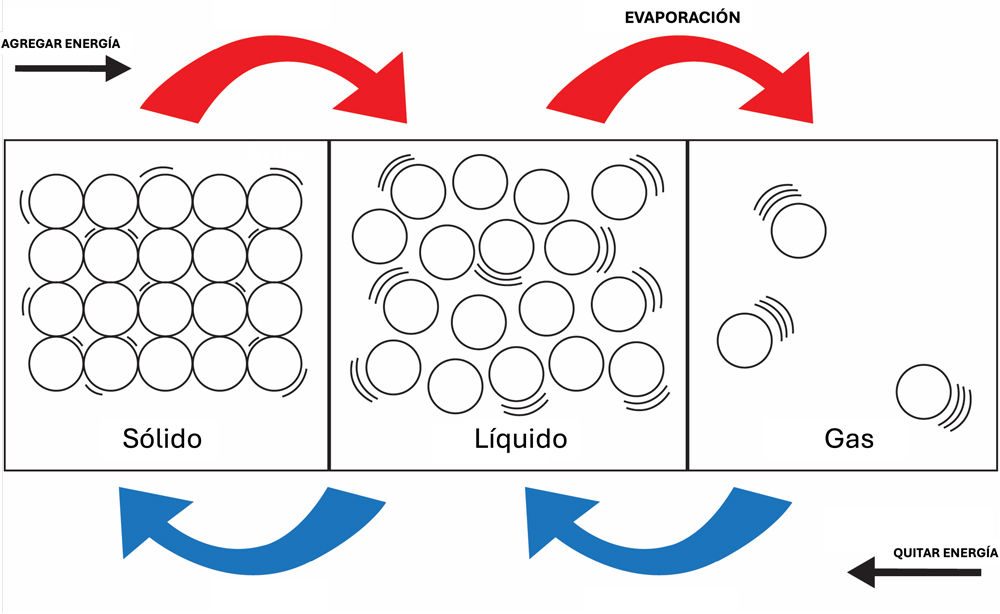
Compara el movimiento y la disposición de las moléculas de una sustancia (distinta del agua) para cada estado de la materia.
Proyecta la imagen Estados de la materia.
Explica que el diagrama ilustra el movimiento y la disposición de los átomos o las moléculas en una sola sustancia (distinta del agua) cuando cambia entre sólido, líquido y gas.
Paso 6
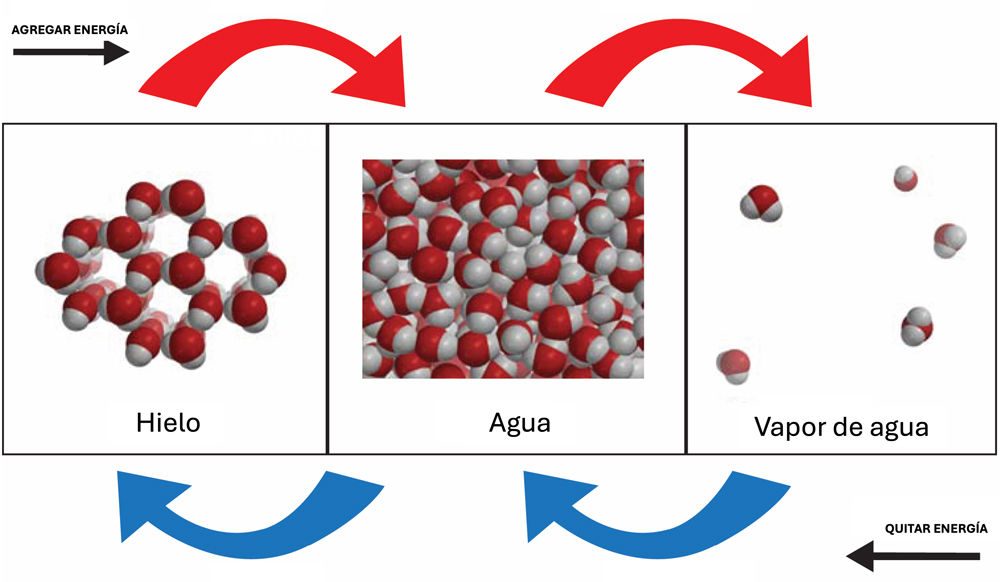
Pide a los alumnos que comparen los cambios de estado de la mayoría de las sustancias con los cambios de estado del agua.
Proyecta la imagen Estados del agua.
Diles a los alumnos que el movimiento de las moléculas de agua en cada estado de la materia es similar a lo que sucede con la mayoría de las sustancias. Agregar energía aumenta el movimiento de las moléculas y hace que se alejen aún más. Quitar energía disminuye el movimiento de las moléculas y hace que estas se acerquen. Pero el agua hace algo muy inusual cuando se congela y se convierte en hielo. Las moléculas, que se estaban acercando más y más, se separan a medida que se organizan en el patrón de anillo abierto que se muestra a continuación para el hielo. Por este motivo, el hielo se expande cuando se congela.
Pregunta a los alumnos:
- ¿Cuáles son las similitudes y diferencias de los cambios de estado en el agua y los cambios de estado en la mayoría de las otras sustancias?
En el caso del agua o de cualquier otra sustancia, el movimiento molecular aumenta cuando se agrega energía y disminuye cuando se quita energía. La principal diferencia entre el agua y otras sustancias es la disposición entre las moléculas del sólido y del líquido. En el agua, las moléculas de hielo están más separadas que en el agua líquida. Esto es inusual, porque las moléculas de los sólidos en la mayoría de las otras sustancias están más cerca que cuando están en estado líquido.
Obtén más información sobre la energía y los cambios de estado en la Información contextual para el maestro.
- Lección 2.5 Información contextual para el maestro PDF
Paso 7
Haz que los grupos utilicen sus moléculas de agua para modelar el congelamiento, la fusión, la evaporación y la condensación.
Haz que cada grupo organice sus moléculas de agua en un anillo de hielo de seis lados. Pide a los alumnos que manejen sus modelos con cuidado porque los necesitarán para otras lecciones.
- El hielo se derrite.
Pide a los alumnos que usen sus modelos para representar lo que sucede cuando el hielo se derrite. Comenta que las moléculas de agua están más cerca entre sí que cuando estaban en forma de hielo. Los alumnos pueden mostrar las moléculas de agua que se mueven en relación con las demás. - El agua se evapora.
Pide a los alumnos que usen sus moléculas para representar lo que sucedería si se calentara el agua y las moléculas se evaporaran. Los alumnos deben mostrar las moléculas de agua moviéndose más rápido, liberándose de las otras moléculas e ingresando al aire. - El vapor de agua se condensa.
Pide a los alumnos que usen sus moléculas para representar lo que sucedería si el vapor de agua se enfriara lo suficiente como para hacer que se condense. Los alumnos deben mostrar cómo las moléculas de agua que se encuentran en el aire se desaceleran y se unen, pero aún se mueven en relación con las demás cuando están en forma de agua líquida.
Recolecta las moléculas de agua. Estos modelos se utilizarán nuevamente en el Capítulo 5.
5 Amplía
Paso 8
Haz una demostración para comparar cómo se derrite el hielo común y el hielo seco.
Cuéntales a los alumnos que el hielo seco es gas de dióxido de carbono congelado. El gas de dióxido de carbono debe estar muy frío para que se solidifique (alrededor de -78 °C o -109 °F).
Preparación
Necesitarás un poco de hielo seco para esta demostración. Si no puedes obtener hielo seco, muestra el video Hielo seco.
Pregunta para investigar
¿El hielo seco se funde de la misma manera que el hielo común?
Materiales
- Hielo
- Hielo seco
- Toalla de papel marrón
- Agua fría
- Agua caliente (aproximadamente a 50 °C)
Procedimiento
- Coloca un trozo de hielo seco y un trozo de hielo común sobre una toalla de papel marrón.
Resultados esperados
En un corto período de tiempo, el hielo comenzará a derretirse y la toalla de papel alrededor del hielo se humedecerá y oscurecerá. La toalla de papel alrededor del hielo seco permanecerá seca y no se oscurecerá. Si observas una pequeña mancha oscura en la toalla de papel cerca del hielo seco, es posible que el vapor de agua presente en el aire se haya condensado sobre el hielo seco y se haya derretido sobre la toalla de papel.
Si los alumnos ven una niebla blanquecina proveniente del hielo seco, diles que no es el gas de dióxido de carbono en sí. El dióxido de carbono es incoloro, inodoro e invisible. El humo o la niebla es, en realidad, vapor de agua del aire que se enfría lo suficiente como para condensarse. El hielo seco y el gas de dióxido de carbono enfrían al vapor de agua. La niebla tiende a desviarse hacia abajo porque es transportada por el gas de dióxido de carbono, que es más denso que el aire que lo rodea.
Paso 9
Analiza las observaciones de los alumnos y presenta la idea de que algunas sustancias pueden cambiar directamente de sólido a gas
Pregunta a los alumnos:
- ¿El hielo común y el hielo seco se derriten de la misma manera?
No. El hielo común cambia a un líquido, que se puede ver en la toalla de papel marrón. El hielo seco no parece cambiar a líquido.
Explica a los alumnos que el motivo por el cual el hielo seco no hace que la toalla de papel se humedezca es porque no se derrite. Cuando se transfiere energía al hielo seco, el dióxido de carbono sólido no se derrite a dióxido de carbono líquido. En cambio, el sólido cambia directamente a un gas. Este proceso se llama sublimación. La sublimación ocurre cuando las moléculas de un sólido se mueven lo suficientemente rápido como para superar las atracciones de otras moléculas y convertirse en un gas. Dado que el dióxido de carbono congelado nunca se convierte en líquido a una presión normal, se denomina hielo seco.
Paso 10
Muestra a los alumnos lo que sucede cuando se coloca hielo seco en el agua.
Coloca una pieza de hielo seco en agua o muestra el video Hielo seco en agua.
Resultados esperados
Se formarán burbujas y se producirá una niebla blanquecina. Dado que el agua es mucho más cálida que el hielo seco, se transfiere energía del agua al hielo seco, lo que hace que cambie de sólido a gas y que se formen burbujas en el agua. Después de agregar detergente, se formarán muchas burbujas.
Los alumnos sentirán curiosidad acerca de la neblina que sale del vaso. Diles que algo del agua cambia a vapor de agua dentro de las burbujas del gas de dióxido de carbono y luego se condensa. Esto provoca una niebla dentro de las burbujas que se escapa cuando estas explotan.
Pregunta a los alumnos:
- Han visto que el hielo seco se sublima muy rápidamente en el agua. ¿Qué podrían hacer para que el hielo seco se sublime aún más rápido?
Hay varias formas de hacer que el hielo seco se sublime más rápido. Una opción es ponerlo en agua caliente.
Coloca un trozo de hielo seco en 1/4 vaso de agua fría y otro trozo en 1/4 vaso de agua caliente. O muestra el video Hielo seco en agua caliente y fría.
Resultados esperados:
Se producirá mucha más neblina a partir del vaso con agua caliente.
Informa a los alumnos que se produce más neblina cuando se coloca hielo seco en agua caliente porque la transferencia de energía y la sublimación ocurren mucho más rápido. Esto hace que la neblina se produzca a mayor velocidad.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Descargas
Para los estudiantes
- Lección 2.5 Hoja de actividades PDF | DOCX | Google Doc
Para los maestros
- Lección 2.5 Plan de lección PDF | DOCX | Google Doc
- Lección 2.5 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
- Lección 2.5 Información contextual para el maestro PDF
Recursos para el Capítulo 2
- Capítulo 2 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 2 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda