La densidad—líquidos que se hunden y flotan
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- Dado que la densidad es una propiedad característica de una sustancia, cada líquido tiene su propia densidad característica.
- La densidad de un líquido determina si flota o se hunde en otro líquido.
- Un líquido flotará si es menos denso que el líquido en el que se coloca.
- Un líquido se hundirá si es más denso que el líquido en el que se coloca.
Resumen
Los alumnos observarán tres líquidos domésticos superpuestos uno sobre el otro y concluirán que sus densidades deben ser diferentes. Deberán predecir las densidades relativas de los líquidos y luego medirán su volumen y masa para ver si sus cálculos coinciden con sus observaciones y predicciones.
Objetivo
Los alumnos podrán determinar si un líquido se hunde o flota en el agua, al comparar su densidad con la densidad del agua.

Seguridad
Asegúrate de que tú y tus alumnos usen gafas protectoras adecuadas. Cuando utilices alcohol isopropílico, lee y respeta todas las advertencias de la etiqueta. El alcohol isopropílico es inflamable. Mantente alejado de cualquier llama o fuente de chispa. Pide a los alumnos que se laven las manos después de la actividad.
Materiales para cada grupo
- Balanza
- Alcohol isopropílico, al 70 % o más
- Agua
- Cilindro graduado
- 2 vasos altos de plástico transparentes, idénticos
- 2 velas de té
Materiales para la demostración
- Balanza
- Alcohol isopropílico, al 70 % o más
- Agua
- Cilindro graduado
- 2 vasos altos de plástico transparentes, idénticos
- 2 velas de té
Notas sobre los materiales
Alcohol isopropílico
Las demostraciones y la actividad funcionan mejor con una solución de alcohol isopropílico al 91 %, que se encuentra disponible en muchos supermercados y farmacias. Si no es posible encontrar una solución al 91 %, también sirve que sea al 70 %, pero es posible que la vela no se hunda. Si eso sucede, no haga la demostración. Si bien la solución de alcohol isopropílico está constituida por el 91 % de alcohol y el 9 % de agua, puedes ignorar esa pequeña cantidad de agua para los fines de esta lección.
Balanza
Una simple balanza es todo lo que se requiere para la segunda demostración. Una de las más accesibles es la balanza apilable Delta Education (21 pulgadas), producto n.° 020-0452-595. Los alumnos pueden usar la versión más pequeña de la misma balanza, la balanza apilable Delta Education (12 pulgadas), producto n.° 023-0724-595.
Descarga todos los recursos de la Lección 3.5
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 3.5: La densidad—líquidos que se hunden y flotan."
Instrucciones
1 Involúcrate
Paso 1
Haz dos demostraciones para probar que los diferentes líquidos tienen diferentes densidades.
Materiales
- Balanza
- Alcohol isopropílico, al 70 % o más
- Agua
- Cilindro graduado
- 2 vasos altos de plástico transparentes, idénticos
- 2 velas de té
Preparación del maestro
- Usa un cilindro graduado para medir 50 ml de agua y verterlos en un vaso de plástico transparente.
- Mide 50 ml de alcohol isopropílico y viértelos en otro vaso plástico transparente idéntico.

Procedimiento
Demostrar la densidad de dos líquidos mediante el hundimiento y la flotación
- Colocar una vela de té en un vaso con agua y otra vela de té en un vaso con alcohol.
- Sostén los dos vasos.
Resultados esperados
La vela flotará en el agua y se hundirá en el alcohol.
Pregunta a los alumnos:
- ¿Qué podría causar que una vela flote y que la otra se hunda?
Explica que las dos velas son iguales. Los alumnos deben razonar que los líquidos deben ser diferentes y tener densidades diferentes. Explica que la taza con la vela que flota contiene agua y la taza con la vela que se hunde contiene alcohol isopropílico. - ¿Creen que estos dos líquidos tienen las mismas o diferentes densidades?
Los alumnos deben concluir que los líquidos deben tener densidades diferentes. Incluso pueden darse cuenta de que el agua es más densa y el alcohol es menos denso que la vela de cera.
Procedimiento
Demostrar la densidad de dos líquidos comparando la masa de volúmenes iguales
- Retira las velas de cada líquido e informa a los alumnos que cada vaso contiene el mismo volumen de líquido.
- Coloca cuidadosamente los vasos con agua y alcohol en los extremos opuestos de una balanza.
Resultados esperados
El agua pesará más que el alcohol.
Pregunta a los alumnos:
- ¿Qué líquido es más denso?
Los alumnos deben estar de acuerdo en que el agua es más densa que el alcohol. - ¿Cómo lo saben?
Dado que el agua tiene más masa que un volumen igual de alcohol, el agua debe ser más densa.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 3.5 Hoja de actividades PDF | DOCX | Google Doc
- Lección 3.5 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Mira la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explora
Paso 2
Demostrar que los líquidos pueden flotar o hundirse en otros líquidos haciendo una columna de densidad con agua, aceite y alcohol.
Materiales para la demostración
- Cilindro graduado
- Agua
- Aceite vegetal
- Alcohol isopropílico, al 70 % o más
Nota: Si deseas que los líquidos sean más visibles, agrega 1 gota de colorante alimenticio al agua y otra gota al alcohol, de un color diferente.
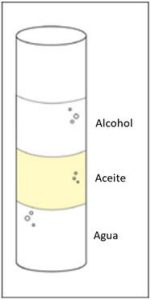
Procedimiento
- Vierte 15 ml de agua en el cilindro graduado. Agrega gradualmente unos 15 ml de aceite. Luego, vierte lentamente unos 15 ml de alcohol por encima. Los líquidos deben formar capas en el cilindro graduado.
- Muestra a los alumnos los líquidos dispuestos en capas en el cilindro graduado y comenta que el alcohol flota en el aceite, mientras que el agua se hunde.
Resultados esperados
El alcohol flota en el aceite y el agua se hunde en el aceite. El agua, el alcohol y el aceite se distribuyen bien en capas debido a sus densidades, pero también porque la capa de aceite no se disuelve en ninguno de los líquidos. El aceite mantiene al agua y al alcohol separados de modo que no se disuelvan entre sí.
Pregunta a los alumnos:
- ¿Por qué el alcohol flota en el aceite?
Deben concluir que el alcohol flota porque es menos denso que el aceite. - ¿Por qué el agua se hunde en el aceite?
El agua se hunde porque es más densa que el aceite. Explica que, al igual que los sólidos, los líquidos están hechos de átomos y moléculas, con una masa y un tamaño determinados. Según la masa de las moléculas que forman un líquido y de cuán apretadas están, los líquidos tienen sus propias densidades. - En la actividad, compararán la masa de volúmenes iguales de cada líquido. ¿Qué líquido creen que tendrá la mayor masa? ¿La menor masa? ¿La de masa intermedia?
Los alumnos deben predecir que el agua pesará más, el alcohol pesará menos y el aceite vegetal tendrá un peso en algún punto intermedio.
Paso 3
Calcular la densidad del agua, el alcohol y el aceite.
Pregunta para investigar
¿Por qué el agua se hunde en el aceite y el alcohol flota cuando está en aceite?
Materiales para cada grupo
- Agua
- Aceite vegetal
- Alcohol isopropílico (al 70 % o más)
- Cilindro graduado
- Balanza que realiza la medición en gramos
Esta actividad está diseñada para que los alumnos tomen mediciones reales de la masa y el volumen, y calculen la densidad de cada líquido. Haz hincapié en que los alumnos deben asegurarse de medir con precisión el volumen y la masa de cada líquido.
Procedimiento
- Averigua la masa de un cilindro graduado vacío. Registra la masa en gramos en la tabla de la hoja de actividades.
- Vierte 20 ml de agua en el cilindro graduado. Intenta ser lo más preciso posible verificando que el menisco esté exactamente en la marca de los 20 ml.
- Pesa el cilindro graduado, ahora con el agua. Registra la masa en gramos.
- Para encontrar la masa de agua, debes restarle la masa del cilindro graduado vacío. Registra la masa de 20 ml de agua en el cuadro.
- Usa la masa y el volumen del agua para calcular la densidad. Registra la densidad en g/cm3 en la tabla.
- Sigue los pasos 2 a 5 para el alcohol y luego para el aceite. Asegúrate de medir el aceite al final porque no es fácil enjuagarlo del cilindro graduado.
| Agua | Alcohol | Aceite |
Masa del cilindro graduado + líquido (g) |
|
|
|
Masa del cilindro graduado vacío (g) |
|
|
|
Masa del líquido (g) |
|
|
|
Densidad del líquido (g/cm3) |
|
|
|
Paso 4
Analizar si las densidades calculadas están de acuerdo con el orden de las capas de líquidos en el cilindro graduado.
Pregunta a los alumnos:
- ¿Las densidades calculadas explican por qué los líquidos flotan y se hunden unos en otros? Explica.
Sí, el agua es el más densa y se hunde en el aceite. El alcohol es el menos denso y flota en el aceite.
4 Explica
Paso 5
Comparar la densidad del agua, el alcohol y el aceite a nivel molecular.
Según la masa y el tamaño de las moléculas que forman los diferentes líquidos y de cuán apretadas están, los líquidos tienen sus propias densidades características.
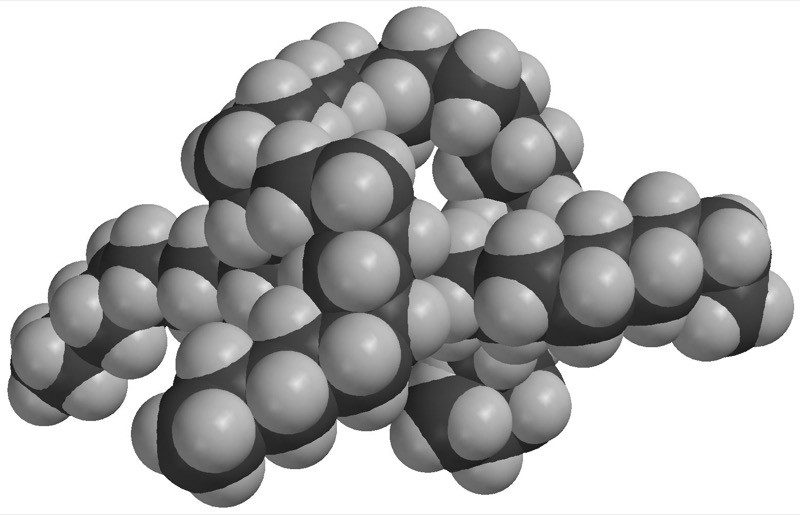
Proyecta la imagen Aceite
Diles a los alumnos que las moléculas de aceite están principalmente hechas de átomos de carbono y de hidrógeno enlazados entre sí.
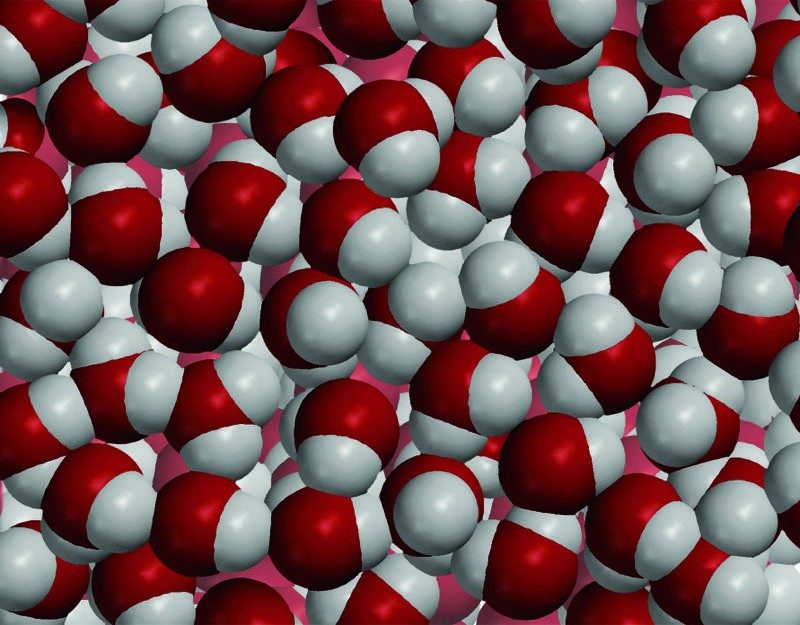
Proyecta la imagen Agua
Las moléculas de agua están compuestas por átomos de oxígeno y de hidrógeno enlazados entre sí. El oxígeno es más pesado y más pequeño que el carbono, por lo que un volumen de moléculas de agua es más pesado que el mismo volumen de moléculas de aceite. Esto hace que el agua sea más densa que el aceite. Además, las moléculas de agua están muy atraídas entre sí y muy apretadas con las demás. Este es otro motivo por el cual el agua es más densa que el aceite.
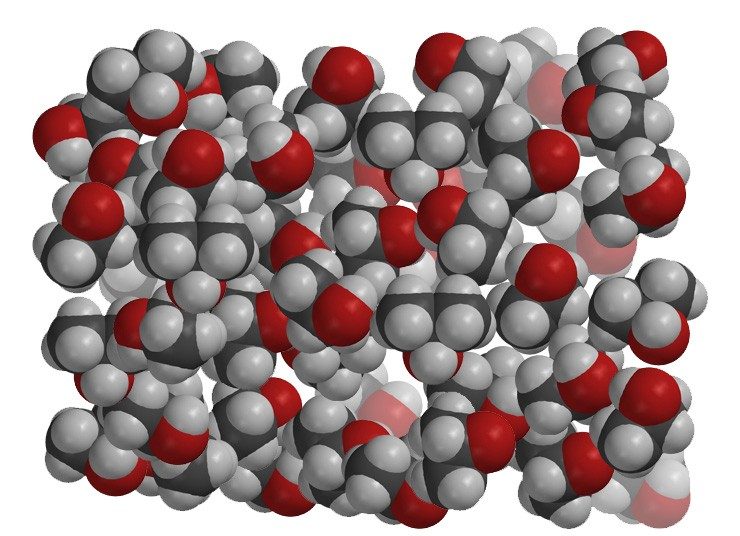
Proyecta la imagen Alcohol
El alcohol es menos denso que el aceite. Las moléculas de alcohol son principalmente átomos de carbono e hidrógeno, por lo que son similares al aceite. Pero también contienen un átomo de oxígeno, que los hace un poco pesados. Por este motivo, podría pensarse que el alcohol sería más denso que el aceite. Pero las moléculas de alcohol no están muy apretadas. Debido a su forma y tamaño, las moléculas de alcohol no están tan eficientemente apretadas como las moléculas de aceite, lo que hace que el alcohol sea menos denso que el aceite.
5 Amplía
Paso 6
A modo de demostración, cambiar la densidad del agua de modo que la rodaja de zanahoria que se hundía ahora flote.
Puedes elegir hacer lo siguiente como demostración o como una actividad para que los alumnos realicen.
Materiales
- Vaso alto de plástico transparente
- Agua
- Rodaja de zanahoria de aproximadamente ¼ pulgada de espesor
- Sal
- Cuchara
Procedimiento
- Vierte agua en un vaso de plástico alto transparente hasta que esté lleno hasta más o menos la mitad.
- Coloca una rodaja de zanahoria en el agua.
Pregunta a los alumnos:
- ¿La zanahoria es más o menos densa que el agua?
Dado que la zanahoria se hunde, los alumnos deben concluir que la zanahoria es más densa que el agua.
- Agrega aproximadamente 1 cucharadita de sal al agua y agita. Continúa revolviendo hasta que la zanahoria flote en la superficie del agua salada. Si la zanahoria no flota a la superficie, agrega más sal y revuelve.
Resultados esperados
La rodaja de zanahoria debe flotar en el agua salada.
Pregunta a los alumnos:
- ¿Es más o menos densa que el agua salada?
Dado que la zanahoria flota en el agua salada, los alumnos deben concluir que la zanahoria es menos densa que el agua salada. - ¿Cómo cambia la densidad del agua la adición de sal?
Disolver sal en agua aumenta tanto la masa como el volumen del agua, pero aumenta más la masa. Debido que D = m/v, aumentar la masa más que el volumen produce un aumento en la densidad. - ¿Qué esperarían al colocar volúmenes iguales de agua y agua salada en los extremos opuestos de una balanza?
Si colocas volúmenes iguales de agua y agua salada en los extremos opuestos de una balanza, el agua salada sería más pesada.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Simulaciones
Vea todas las imágenes de la Lección 3.5 en la página de simulaciónes.
Descargas
Para los estudiantes
- Lección 3.5 Hoja de actividades PDF | DOCX | Google Doc
Para los Maestros
- Lección 3.5 Plan de lección PDF | DOCX | Google Doc
- Lección 3.5 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Recursos para el Capítulo 3
- Capítulo 3 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 3 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda