Un catalizador y la velocidad de reacción
Video de resumen de la leccion para maestros
Nota: Este video está diseñado para ayudar al maestro a comprender mejor la lección y NO está destinado a ser mostrado a los estudiantes. Incluye observaciones y conclusiones que los estudiantes deben hacer por sí solos.
Los subtítulos están disponibles en inglés y español para todos los videos.
Conceptos clave
- Un catalizador es una sustancia que puede ayudar a los reactivos en una reacción química a reaccionar entre sí más rápidamente.
- Un catalizador no pasa en verdad a formar parte de los productos de la reacción.
Resumen
Los alumnos ven un video y realizan una actividad rápida para ver que un catalizador puede aumentar la velocidad de la desintegración (descomposición) del peróxido de hidrógeno. A continuación, los alumnos utilizarán la sal como catalizador en una reacción entre una lámina de aluminio y una solución de sulfato de cobre II. Se presentará a los alumnos el concepto de que un catalizador aumenta la velocidad de una reacción química, pero no se incorpora a los productos de la reacción.
Objetivo
Los alumnos podrán definir un catalizador como una sustancia que aumenta la velocidad de una reacción química, pero que no se incorpora a los productos de la reacción.

Seguridad
Asegúrate de que tú y los alumnos usen las gafas protectoras adecuadas. Cuando utilices peróxido de hidrógeno, sigue todas las advertencias de la etiqueta. Después de que los alumnos hayan realizado la actividad con la solución de sulfato de cobre II y la lámina de aluminio, deja que el contenido del vaso se evapore. Coloca la pequeña cantidad de sólido en una toalla de papel y deséchala en la basura o utiliza el método de eliminación requerido por la normativa local.
Materiales para cada grupo
- Cilindro graduado (de 50 ml o 100 ml)
- Peróxido de hidrógeno (3 %)
- Vaso pequeño
- Vaso de plástico transparente
- Solución de sulfato de cobre II (en vaso)
- Sal
- Lámina de aluminio (5 cm × 5 cm)
- Termómetro
- Levadura
- 2 palitos de helado
- Solución detergente
- Gotero
Descarga todos los recursos de la Lección 6.5
Obtenga el plan de lección completo y la hoja de actividades para la "Lección 6.5: Un catalizador y la velocidad de reacción."
Instrucciones
1 Involúcrate
Paso 1
Muestra a los alumnos dos demostraciones y pídeles que busquen pruebas de que se produce un gas en las reacciones químicas.
Diles a los alumnos que les mostrarás videos de dos demostraciones en las que se producen vapor de agua y gas de oxígeno en la misma reacción química. Dado que los gases son invisibles, pide a los alumnos que observen atentamente en busca de evidencia de que se produce un gas.
Proyecta el video Pasta dental de elefante.
La espuma muestra que los gases (oxígeno y vapor de agua) se producen muy rápidamente. La cantidad de espuma producida en un período de tiempo es una forma de medir la velocidad de la reacción.
Proyecta el video Genio de la lámpara.
El vapor que sale de la botella es vapor de agua que se condensa a medida que sale de la botella. El oxígeno también sale de la botella, pero es invisible.
Pregunta a los alumnos:
- ¿Cómo podrían saber que se produce un gas en la reacción química?
La formación de espuma en la demostración de la pasta de dientes de elefante significa que se produce un gas. La producción de un gas es un indicio de que se ha producido una reacción química. El vapor de agua en la demostración del genio de la lámpara también muestra la producción de un gas.
Diles a los alumnos que esta lección trata sobre la aceleración de las reacciones químicas. Algunas reacciones se producen muy lentamente, pero se pueden añadir sustancias químicas llamadas catalizadores para que sean más rápidas. Ambas demostraciones estuvieron basadas en un catalizador.
2 Evalúa
Entrega a cada alumno una hoja de actividades.
- Lección 6.5 Hoja de actividades PDF | DOCX | Google Doc
- Lección 6.5 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Descarga la hoja de actividades y distribuya una por alumno.
La hoja de actividades servirá como el componente de evaluación de cada plan de lección 5-E. Las hojas de actividades son evaluaciones formativas del progreso y la comprensión de los alumnos. Al final de cada capítulo se incluye una evaluación sumativa más formal.
Los alumnos registrarán sus observaciones y responderán preguntas sobre la actividad en la hoja de actividades. Las secciones Explícalo con átomos y moléculas y Aprende más de la hoja de actividades se completarán en conjunto con la clase, en grupos o individualmente, según tus instrucciones. Observa la versión para el maestro de la hoja de actividades para encontrar las preguntas y respuestas.
3 Explica
Paso 2
Describe cómo la descomposición del peróxido de hidrógeno produjo gas de oxígeno en ambos videos.
Diles a los alumnos que ambas demostraciones utilizan una solución de peróxido de hidrógeno al 30 %. Normalmente, el peróxido de hidrógeno que se puede comprar en la tienda es un peróxido de hidrógeno de solo el 3%.
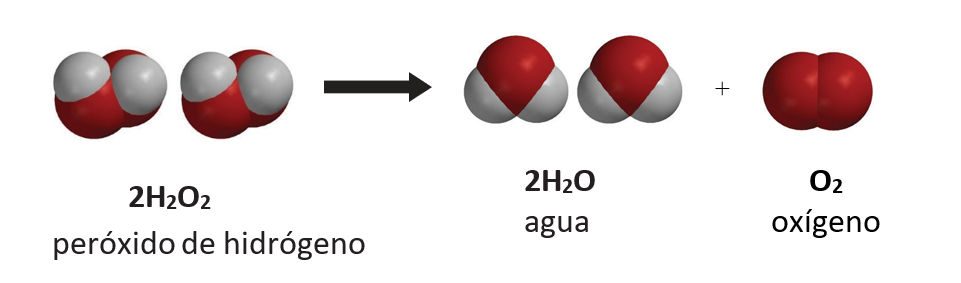
Explica a los alumnos que la fórmula química del peróxido de hidrógeno es H2O2. Señala que el peróxido de hidrógeno no es muy estable y se descompone en agua y oxígeno. Este tipo de cambio es una reacción química llamada descomposición. La descomposición del peróxido de hidrógeno es lenta y normalmente no es perceptible.
Proyecta la imagen Descomposición del peróxido de hidrógeno.
Explica que el peróxido de hidrógeno se descompone para formar agua y oxígeno de acuerdo con la siguiente ecuación química:
4 Explora
Paso 3
Pide a los alumnos que usen levadura para catalizar la descomposición del peróxido de hidrógeno.
Pregunta para investigar
¿Puede otra sustancia catalizar la descomposición del peróxido de hidrógeno?
Materiales para cada grupo
- Cilindro graduado
- Peróxido de hidrógeno (3%)
- Levadura
- Palito de helado
- Solución detergente
- Gotero
Preparación del maestro
Prepara una solución detergente añadiendo 1 cucharadita de detergente líquido a 2 cucharadas de agua. Divide esta solución detergente en partes iguales en un vaso pequeño para cada grupo.
Procedimiento
- Añade 10 ml de peróxido de hidrógeno a un cilindro graduado. Añade 1 gota de solución detergente. Agita suavemente y observa si la solución forma burbujas.
Explica a los alumnos que el detergente solo se añade para formar burbujas si se produce gas. Dado que la descomposición del peróxido de hidrógeno produce gas de oxígeno, el burbujeo muestra que el peróxido de hidrógeno se está descomponiendo. La falta de burbujas muestra que no se produce mucho gas de oxígeno.

- Utiliza el extremo de un palito de helado para añadir una pequeña cantidad de levadura al peróxido de hidrógeno en el cilindro graduado y agita.
- Coloca el cilindro graduado sobre la mesa y observa si hay burbujas.
- Sujeta el cilindro graduado para ver si parece haber algún cambio en la temperatura.
Resultados esperados
Antes de añadir la levadura, no hay burbujas observables. Después de añadir la levadura, el burbujeo hará que la espuma suba por el cilindro graduado. Además, el cilindro graduado debe sentirse un poco más caliente porque la descomposición del peróxido de hidrógeno libera energía. Los cambios energéticos en las reacciones químicas se investigarán con más detalle en el Capítulo 6, Lección 7. Analiza las observaciones de los alumnos.
Pregunta a los alumnos:
- ¿Qué pistas tenían de que se produjera una reacción química en esta actividad?
Burbujas. Informa a los alumnos de que un cambio en la temperatura también es un signo de que puede estar produciéndose una reacción química. Las reacciones químicas endotérmicas y exotérmicas se abordarán en el capítulo 6, tema 7. - ¿Cuál es el catalizador en esta actividad?
Una sustancia en la levadura. - ¿Qué evidencia tienes de que el peróxido de hidrógeno se disolvió más rápido cuando añadiste la levadura?
Se produjeron burbujas de gas de oxígeno después de añadir la levadura. - Cuando escribas la ecuación química para esta reacción, ¿debe incluirse la levadura en el lado del producto de la ecuación química?
Explica a los alumnos que el catalizador de la levadura no acaba en los productos, sino que es una sustancia que ayuda a que la descomposición se produzca más rápido. A veces, un catalizador se escribe por encima o por debajo de la flecha en una ecuación química, pero nunca se incluye con los reactivos o productos.
En general, los catalizadores funcionan proporcionando un lugar en el que los reactivos puedan unirse para reaccionar. Explica a los alumnos que las células de levaduras y otros organismos contienen un catalizador llamado catalasa. A través de los procesos celulares normales, los seres vivos producen peróxido de hidrógeno en sus células. Pero el peróxido de hidrógeno es un veneno, por lo que las células necesitan una forma de descomponerlo muy rápidamente. La catalasa de la célula descompone el peróxido de hidrógeno a una velocidad muy rápida. Una sola molécula de catalasa puede catalizar la descomposición de millones de moléculas de peróxido de hidrógeno cada segundo.
Los alumnos pueden seguir explorando el efecto de la catalasa en el peróxido de hidrógeno añadiendo un trozo de patata fresca a una pequeña cantidad de peróxido de hidrógeno.
5 Amplía
Paso 4
Haz que los alumnos identifiquen los cambios que se producen cuando el sulfato de cobre II reacciona con una lámina de aluminio.
Nota: Esta es una reacción entre el sulfato de cobre II y el aluminio. El cobre se denomina “cobre II” porque el cobre puede producir diferentes tipos de iones. Puede perder un electrón y ser solo Cu+ o puede perder dos electrones y ser Cu2+. Este tipo de ion de cobre se denomina cobre II. Asimismo, el “sulfato” en el sulfato de cobre II es, además, un ion. Este ion está compuesto por más de un átomo. Es uno de los iones poliatómicos tratados en el Capítulo 4, Lección 3. El sulfato está compuesto por un átomo de azufre enlazado a cuatro átomos de oxígeno y se trata como un ion (SO42-).
Existen varios aspectos interesantes de la reacción entre el sulfato de cobre II y el aluminio, pero es diferente de las otras reacciones que han visto los alumnos hasta el momento. En esta reacción, el movimiento de electrones, en lugar de átomos, iones o moléculas completos, es lo que provoca que se produzca la reacción. Este tipo de reacción se denomina reacción de oxidación/reducción. Esta reacción en particular es divertida de hacer porque es exotérmica, genera un gas y el metal de cobre aparece a medida que desaparece el metal de aluminio.
La sal puede considerarse un catalizador en la reacción, pero juega un papel diferente al de la mayoría de los catalizadores. El sulfato de cobre II y el aluminio reaccionan muy lentamente porque el aluminio está recubierto por una capa muy fina deslustrada (de óxido de aluminio). Esta reacción se puede acelerar si la capa de óxido de aluminio se retira o se ve comprometida. Añadir sal hace esto y permite que los electrones del aluminio reaccionen con los iones de cobre de la solución, lo que hace que se conviertan en metal de cobre.
Pregunta para investigar
¿Cuál es el catalizador en la siguiente actividad?
Materiales para cada grupo
- Solución de sulfato de cobre II (en vaso)
- Vaso de plástico transparente (vacío)
- Sal
- Trozo de papel de aluminio
- Termómetro
- Palito de helado
Preparación del maestro
Haz una solución de sulfato de cobre II añadiendo 20 g de sulfato de cobre II a 200 ml de agua. Vierte unos 25 ml de solución de sulfato de cobre II en un vaso para cada grupo. Corta la lámina de aluminio en trozos lo suficientemente grandes como para cubrir el fondo de un vaso (unos 5 cm de largo × 5 cm de ancho).

Procedimiento
- Coloca el trozo de papel de aluminio en un vaso vacío. Utiliza los dedos o un palito de helado para empujar el papel de aluminio firmemente hacia abajo de modo que quede plano y cubra la parte inferior del vaso.
- Añade toda la solución de sulfato de cobre II al vaso con el papel de aluminio.
- Agita suavemente la solución durante unos segundos y déjala quieta. Observa el aluminio para detectar la formación de burbujas o algún cambio de color.
- Utiliza el palito de helado para colocar una pequeña cantidad de sal en la solución de sulfato de cobre II. Agita suavemente la solución durante unos segundos y déjala quieta. Presta atención para detectar la formación de burbujas o algún cambio de color.
- Coloca con cuidado un termómetro en el vaso y comprueba si cambia la temperatura.
Resultados esperados
Antes de añadir la sal, no hay burbujas ni cambios de color. Después de añadir la sal, el color se vuelve verdoso y empiezan a formarse burbujas en el aluminio. Pronto, se empieza a formar material marrón (cobre) en el aluminio. El burbujeo se vuelve más vigoroso y la solución pierde su color azul a medida que el aluminio desaparece y se produce más cobre. La solución también se calienta.
Paso 5
Analiza las observaciones de los alumnos.
Pregunta a los alumnos:
- ¿Cómo saben que se produce una reacción química cuando se coloca un trozo de papel de aluminio y cloruro de sodio en una solución de sulfato de cobre II?
Hubo burbujas, un cambio de color, un aumento de la temperatura y la formación de un sólido diferente. - ¿Cuál es el catalizador en esta actividad?
La sal. - ¿De qué manera añadir sal al aluminio resulta similar a añadir levadura al peróxido de hidrógeno?
Ambos pueden considerarse catalizadores. La adición de levaduras ayuda a que el peróxido de hidrógeno se descomponga más rápidamente y la adición de sal ayuda a que el aluminio reaccione con el sulfato de cobre II.
Diles a los alumnos que la solución azul contiene iones de cobre (Cu2+). Añadir sal a la solución ayuda a eliminar una capa deslustrada de la pieza de aluminio en la solución. Esto expone algo de aluminio y permite que los electrones del aluminio reaccionen con los iones de cobre. Estos electrones negativos se atraen a los iones de cobre positivos. Cuando los electrones se unen a los iones de cobre, los iones se convierten en átomos de cobre neutros y parecen metales de cobre en la solución. A medida que el aluminio pierde sus electrones, se convierte en iones de aluminio que entran en la solución.
¿Qué es el enfoque 5-E?
El modelo de instrucción 5-E es un enfoque de enseñanza y aprendizaje que se centra en la participación activa, el aprendizaje basado en la investigación y la colaboración.
Descargas
Para los estudiantes
- Lección 6.5 Hoja de actividades PDF | DOCX | Google Doc
Para los Maestros
- Lección 6.5 Plan de lección PDF | DOCX | Google Doc
- Lección 6.5 Respuestas de la hoja de actividades PDF | DOCX | Google Doc
Recursos para el Capítulo 6
- Capítulo 6 Lectura de estudiantes PDF | DOCX | Google Doc
- Capítulo 6 Banco de pruebas PDF | DOCX | Google Doc
¿Tiene preguntas? Visita el Centro de ayuda