Lección 4.4: Niveles de energía, electrones y enlaces covalentes
Lección de acompañamiento: Lección 4.4: Niveles de energía, electrones y enlaces covalentes
Interactivo
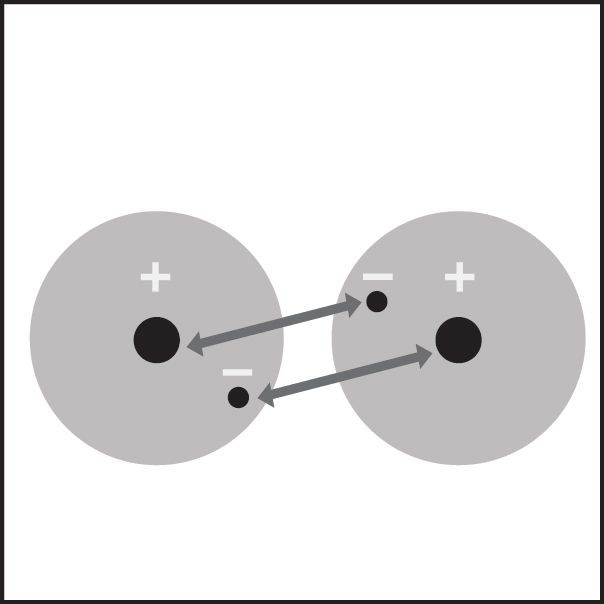
Enlace covalente en hidrógeno 1
- Cuando dos átomos de hidrógeno se acercan lo suficiente, el electrón de cada átomo se siente atraído por el protón en el núcleo del otro átomo.
- Esta atracción une los átomos.
- Los electrones terminan siendo compartidos por los átomos en una región alrededor del núcleo de ambos átomos.
Imagen
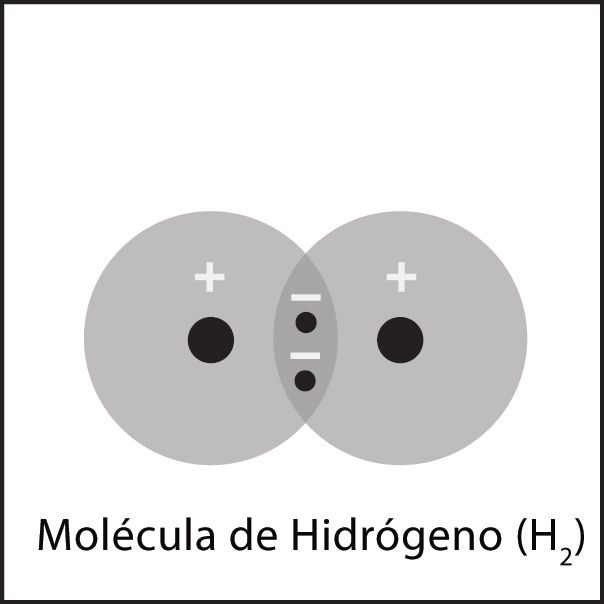
Enlace covalente en hidrógeno 2
- Los átomos de hidrógeno están cerca los unos de los otros. El electrón de cada átomo siente la atracción del protón que se encuentra en el núcleo del otro átomo.
- Esta atracción tiende a unir a los átomos y ambos átomos comparten los electrones.
- Los átomos se unen porque hay una atracción lo suficientemente fuerte en ambas direcciones, así como espacio para los electrones en el nivel exterior de energía de los átomos.
Interactivo
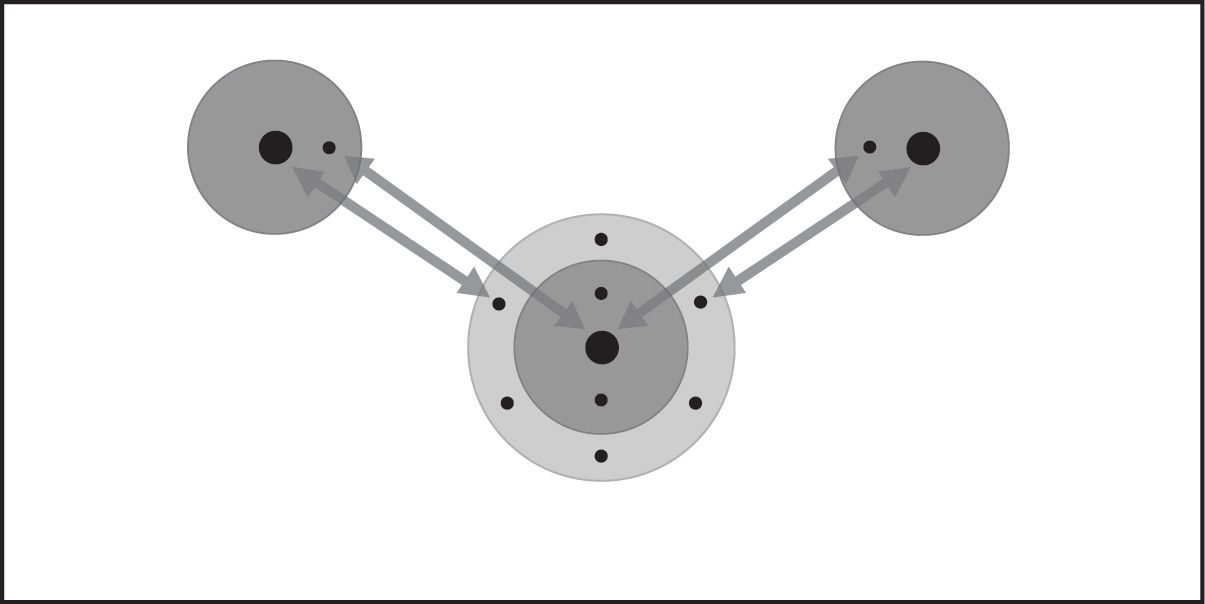
Enlace covalente en agua 1
- Cuando dos átomos de hidrógeno y un átomo de oxígeno se acercan lo suficiente, el electrón de cada átomo se siente atraído por los protones en el núcleo del otro átomo.
- Esta atracción une los átomos.
- Los electrones terminan siendo compartidos por los átomos en una región alrededor del núcleo de ambos átomos.
Imagen
Enlace covalente en agua 2
- Los átomos de hidrógeno y un átomo de oxígeno están cerca los unos de los otros.
- Los electrones de cada átomo sienten la atracción de los protones que se encuentran en el núcleo del otro átomo.
- Esta atracción tiende a unir a los átomos y ambos átomos comparten los electrones.
- Los átomos se unen porque hay una atracción lo suficientemente fuerte en ambas direcciones, así como espacio para los electrones en el nivel exterior de energía de los átomos.
Video
Electrolisis
- La electricidad provoca el reordenamiento de los electrones y átomos de las moléculas de agua.
- Dos átomos de hidrógeno se unen covalentemente para formar gas hidrógeno.
- Dos átomos de oxígeno se unen covalentemente para formar gas de oxígeno.
- Hay el doble de átomos de hidrógeno que átomos de oxígeno, por lo que se forma más gas hidrógeno.
Interactivo
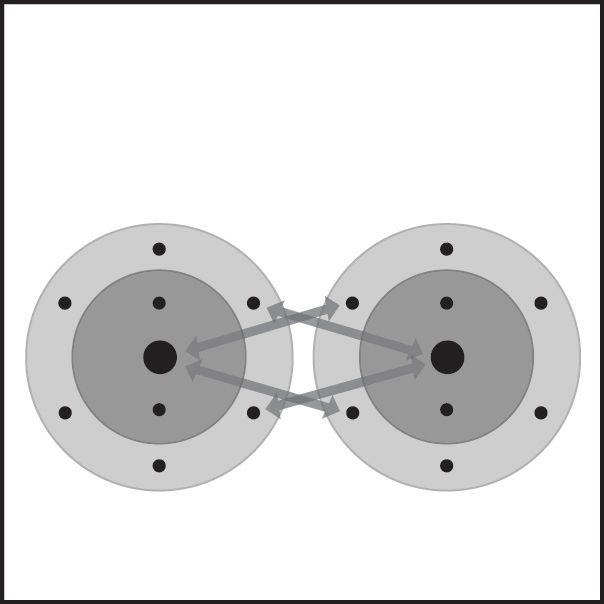
Doble enlace del oxígeno 1
- Los átomos de oxígeno están cerca los unos de los otros.
- Los electrones de cada átomo sienten la atracción de los protones que se encuentran en el núcleo del otro átomo.
- Esta atracción tiende a unir a los átomos y ambos átomos comparten los electrones.
- Los átomos se unen porque hay una atracción lo suficientemente fuerte en ambas direcciones, así como espacio para los electrones en el nivel exterior de energía de los átomos.
Imagen
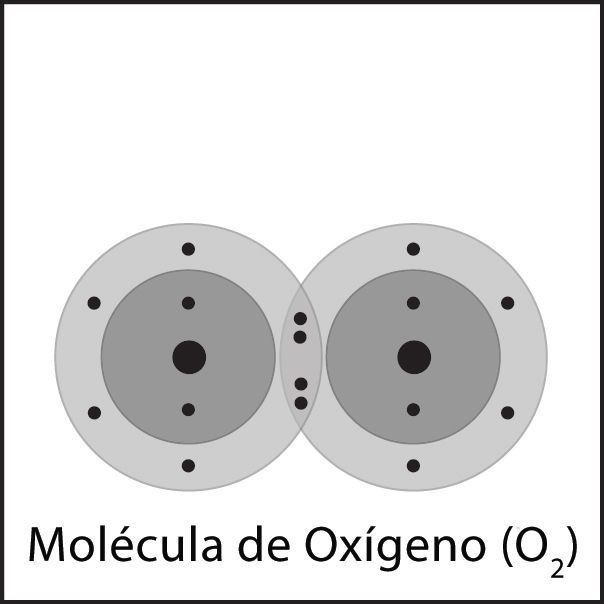
Doble enlace de oxígeno 2
- Los átomos de oxígeno están cerca los unos de los otros.
- Los electrones de cada átomo sienten la atracción de los protones que se encuentran en el núcleo del otro átomo.
- Esta atracción tiende a unir a los átomos y ambos átomos comparten los electrones.
- Los átomos se unen porque hay una atracción lo suficientemente fuerte en ambas direcciones, así como espacio para los electrones en el nivel exterior de energía de los átomos.
Imagen
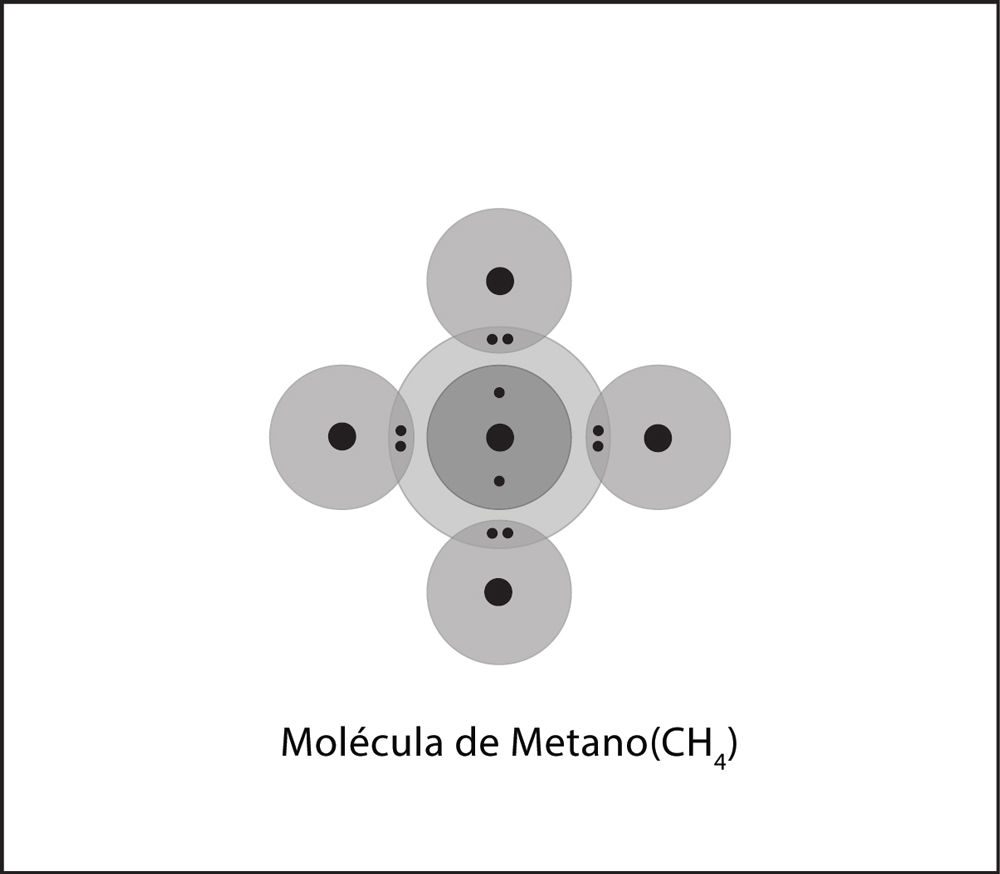
Unión covalente en el metano
- Un átomo de carbono y un átomo de hidrógeno están cerca los unos de los otros.
- Los electrones de cada átomo sienten la atracción del protón que se encuentra en el núcleo del otro átomo.
- Esta atracción tiende a unir a los átomos y ambos átomos comparten los electrones.
- Los átomos se unen porque hay una atracción lo suficientemente fuerte en ambas direcciones, así como espacio para los electrones en el nivel exterior de energía de los átomos.
Imagen
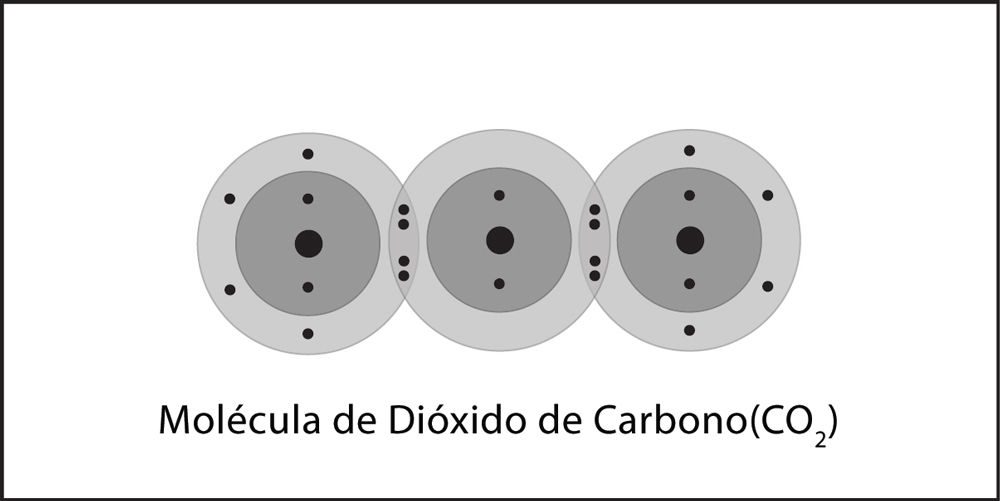
Unión covalente en el dióxido de carbono
- Un átomo de carbono y dos átomos de oxígeno están cerca entre sí.
- Los electrones de cada átomo sienten la atracción de los protones que se encuentran en el núcleo del otro átomo.
- Esta atracción tiende a unir a los átomos y ambos átomos comparten los electrones.
- Los átomos se unen porque hay una atracción lo suficientemente fuerte en ambas direcciones, así como espacio para los electrones en el nivel exterior de energía de los átomos.